Estimar los costes médicos directos en los pacientes con artritis reumatoide (AR) y los factores predictores en los pacientes tratados con fármacos biológicos y sin biológicos.
MétodosSe realizó un estudio transversal en una muestra incluyendo pacientes de toda la geografía nacional. Se obtuvieron datos sociodemográficos y de tratamiento. Se registró la utilización de recursos para los 2 años de estudio y se hizo imputación de costes. Se realizaron análisis de correlación en todos los pacientes con AR y en los tratados con y sin biológicos, para estimar las diferencias entre los grupos. Los predictores de costes se analizaron mediante modelos de regresión lineal.
ResultadosSe incluyeron 1.095 pacientes con AR, el 26% hombres, con una edad media de 62±14 años. La media de los costes médicos directos por paciente fue de 24.291±45.382€. Excluyendo los fármacos biológicos, el coste medio por paciente fue de 3.742±3.711€. Después de ajustar, los factores predictores de costes médicos directos para todos los pacientes con AR fueron los fármacos biológicos (p=0,00), la comorbilidad (p=0,00) y la edad del paciente (p=0,01). En el grupo sin biológicos, los predictores fueron la comorbilidad (p=0,00) y la edad del paciente (p=0,01). En el grupo con biológicos los predictores fueron el sexo del paciente (p=0,03) y la actividad de la enfermedad (p=0,02).
ConclusiónLos datos muestran un notable impacto económico de la AR. Es importante identificar y estimar los factores asociados a mayor coste para desarrollar estrategias de reducción de costes y aumentar la calidad de la atención.
To analyze the resource utilization in rheumatoid arthritis (RA) patients and predictive factors in and patients treated with biological drugs and biologic-naïve.
MethodsA cross-sectional study was performed in a sample including all regions and hospitals throughout the country. Sociodemographic data, disease activity parameters and treatment data were obtained. Resource utilization for two years of study was recorded and we made costs imputation. Correlation analyzes were performed on all RA patients and those treated with biological and biological naïve, to estimate the differences in resource utilization. Factors associated with increased resources utilization (costs) attending to treatment was analyzed by linear regression models.
ResultsWe included 1,095 RA patients, 26% male, mean age of 62±14 years. Mean of direct medical costs per patient was €24,291±€45,382. Excluding biological drugs, the average cost per patient was €3,742±€3,711. After adjustment, factors associated with direct medical costs for all RA patients were biologic drugs (P=.02) and disease activity (P=.004). In the biologic-naïve group, the predictor of direct medical costs was comorbidity (P<.001). In the biologic treatment group predictors were follow-up length of the disease (P=.04), age (P=.02) and disease activity (P=.007).
ConclusionOur data show a remarkable economic impact of RA. It is important to identify and estimate the economic impact of the disease, compare data from other geographic samples and to develop improvement strategies to reduce these costs and increase the quality of care.
La artritis reumatoide (AR) es una enfermedad inflamatoria crónica con una prevalencia de alrededor de 0,8 (0,3-1,0) por cada 100 adultos, con un pico de aparición de la enfermedad entre los 55 y los 64 años1-3. Los pacientes con AR consumen una gran cantidad de recursos de salud como consecuencia de su enfermedad que conduce a un gran coste. Esto tiene un gran impacto en la sociedad, debido a los costes de tratamiento y a la pérdida de productividad. Los estudios de costes sobre la enfermedad llevados a cabo en Europa y EE.UU. estiman unos 4.000-6.000€ por paciente y año4-6.
Las enfermedades reumáticas inflamatorias han experimentado grandes avances debido a varios factores tales como la disponibilidad de nuevos tratamientos, una mejor comprensión de los procesos y el crecimiento en la atención del paciente reumático en nuestro país.
El aumento en el uso de agentes biológicos en la práctica diaria de Reumatología ha aumentado los costes directos de 3 a 6 veces en varios países europeos7,8. Sin embargo, los cambios en los patrones de tratamiento han conseguido una disminución de la actividad media de la enfermedad (DAS28), de la hospitalización, de los días de trabajo perdidos y de la discapacidad laboral9, logrando con esto una disminución de los costes indirectos relacionados con la enfermedad.
En diversos estudios realizados en los años ochenta y noventa 10-13, el principal coste médico fue la hospitalización, que en estos estudios representaba un tercio del coste. En estudios posteriores, el principal coste fueron los fármacos14. Este cambio se asocia con un porcentaje cada vez mayor de los pacientes tratados con agentes biológicos.
El estudio «Variabilidad en el manejo de la artritis reumatoide y las espondiloartritis en España» (EMAR-II) tiene por objetivo describir la variabilidad en términos de consumo de recursos sanitarios y utilización de técnicas y tratamientos, y por esto permite que estos cambios sean descritos en nuestro país. Hospitales de las distintas comunidades autónomas participaron en el estudio, que tuvo un período de inclusión de 2 años (anexo). Esto permitió que se obtuviese una cohorte representativa de la enfermedad en nuestro país.
Hay pocos estudios sobre los costes de la AR en la era biológica, y los que existen son en escenarios en los que estos medicamentos se han utilizado aún muy poco. Por lo tanto, el objetivo de nuestro trabajo fue estimar los costes médicos directos en la cohorte EMAR-II, analizar los posibles factores predictores de estos costes y evaluar estos factores predictores en 2 subpoblaciones distintas: los pacientes que han recibido tratamiento con fármacos biológicos y aquellos que no los han recibido durante el período de estudio.
Material y métodosDiseño, selección de los pacientes y adquisición de datosEl estudio EMAR-II (2009-2010) es un estudio transversal diseñado para analizar la variabilidad en el manejo de los pacientes con AR en España. Se estableció contacto con 100 hospitales, de los cuales 46 aceptaron participar y 54 no aceptaron. La muestra se compone de los registros médicos de los pacientes con AR que fueron vistos en los servicios de Reumatología en los hospitales españoles que tenían por lo menos una visita con el reumatólogo durante los 2 años anteriores a la fecha de inicio del estudio. Con el fin de reclutar a los diferentes centros participantes, el muestreo al azar se estratificó por comunidad autónoma, con el muestreo en 2 etapas por centro hospitalario (unidades de primera etapa) y los pacientes (unidades de segunda etapa). Con el fin de evitar la falta de representatividad asociada con la homogeneidad de las unidades de primera etapa de diversos tamaños, el muestreo se hizo en la primera etapa con una probabilidad proporcional según el tamaño, y en la segunda etapa se realizó un muestreo equiprobable aleatorio de los pacientes de cada centro. Las comunidades autónomas más pequeñas se agruparon con las más grandes con el fin de asegurar que todas eran representativas. Los datos de los últimos 2 años fueron extraídos de la historia clínica del paciente y se recogen en los formularios estandarizados, que eran los mismos para todos los casos, creándose un «Manual de instrucciones» sobre cómo completarlos. Los datos se introdujeron después en una base de datos electrónica diseñada específicamente para este proyecto.
Sujetos de estudio: pacientes con AR seleccionados en EMAR-II, con un total de 1.272 participantes. Variables: se incluyeron las siguientes variables: a) variables sociodemográficas: edad del paciente y género; b) clínicas: tiempo de progresión de la AR, comorbilidad, reactantes de fase aguda (VSG, PCR u otros), los índices de actividad de la enfermedad compuestos (DAS, SDAI u otros), las escalas analógicas visuales (VAS) con la mejor y la peor valoración del médico (VGM) y del paciente (VGP), evaluación de la capacidad funcional de la actividad de la enfermedad (capacidad funcional ACR, HAQ), y una variable llamada actividad de la enfermedad (generada para el estudio), que se compone de un DAS28 activo (≥3,2) en 2 visitas o una VSG alta (≥50) en 2 mediciones o una evaluación subjetiva del médico (VSM) alta (nivel ≥moderado) en 2 visitas, y c) las variables de costes asignados al consumo de recursos sanitarios: número de visitas médicas a otros servicios, número y tipo de visitas no médicas, admisiones hospitalarias relacionadas con la AR, cirugías ortopédicas, estudios adicionales (de laboratorio, diagnóstico por imágenes, otros), artrocentesis, fármacos (antiinflamatorios no esteroideos [AINE], glucocorticoides, fármacos antirreumáticos modificadores de la enfermedad [FAME], fármacos biológicos).
Fuente de datosLos costes directos en este estudio se definen como costes para el sistema español de Seguridad Social, el pagador principal de estos costes en España. El Sistema Nacional de Salud español es un sistema de cobertura universal financiado mediante impuestos y que opera principalmente dentro del sector público. Los servicios son gratuitos en el punto de prestación, con la excepción de los medicamentos recetados a personas menores de 65 años de edad, que deben participar en el pago con una aportación del 40% del precio de venta al público, con algunas excepciones.
Utilizando la base de datos EMAR-II, se generó una base de datos específica para este estudio que incluyó datos de los pacientes con AR y los costes fueron asignados. Dadas las grandes asignaciones de costes necesarias para el estudio, fueron necesarias varias fuentes de datos. Estos fueron proporcionados por los boletines oficiales de las diferentes comunidades autónomas y publicados por los diferentes consejos de salud españoles o Sanidad y Consumo, el Instituto Nacional de Salud, el Instituto de Información Sanitaria y otra fuentes, como la base de datos de costes sanitarios Soikos, versión 2.215-23. Todos los costes se expresan en euros de 2010.
Análisis estadísticoSe realizó una descripción de las variables sociodemográficas, clínicas y de costes de la muestra utilizando la distribución de frecuencias, medias y desviación estándar. Debido a su distribución no normal, la variable dependiente costes fue transformada para acercarse a la normalidad. También se realizó este análisis descriptivo para el grupo de pacientes con fármacos biológicos y para aquellos sin estos fármacos durante el período de estudio. Las diferencias en los costes médicos directos entre los grupos se estimaron utilizando tablas de contingencia y la prueba t de Student.
Se realizaron análisis bivariados y multivariados con el fin de estimar los posibles factores predictores de los costes médicos directos en toda la muestra utilizando modelos de regresión lineal. Después, se realizó un análisis secundario utilizando técnicas de regresión lineal con el fin de estimar las diferencias y los predictores de los costes médicos directos en el grupo que recibió fármacos biológicos y en el grupo que no los recibió. Los datos se muestran para el período de estudio de 2 años. Los análisis se realizaron con el paquete estadístico Stata 10.0 (Stata Corp, College Station, Texas).
ResultadosLa muestra final del estudio se compone de un total de 1.095 pacientes con todos los datos de costes médicos recogidos.
De los pacientes incluidos en el estudio, el 26% eran hombres. La edad media fue de 62±14 años. En cuanto a las características clínicas de la muestra, el tiempo de progresión de la enfermedad fue de 10,2±8,9 años. Un 49,8% de los pacientes tenían algún tipo de comorbilidad asociada, distribuidos de la siguiente manera: nódulos (12,16%), síndrome de Sjögren (10,53%), síndrome del túnel carpiano (6,82%), Raynaud (2,5%), subluxación C1-C2 (2,5%), fibrosis pulmonar (2,3%), pleuritis (1,4%), vasculitis (0,9%), escleritis (0,9%), síndrome de Felty (0,4%), amiloidosis (0,15%). El DAS28 máximo durante el período de estudio se clasificó en pacientes con baja actividad (DAS ≤3,2) en el 27,76%, actividad moderada (DAS 3,2-5,1) en el 45% y una alta actividad (DAS >5,1) en el 27,24%. La VSG tenía valores mínimos promedio de 15,26±14,10 y valores máximos de 38,30±27,13. La VSM tuvo valores mínimos de 15,26±14,10 y valores máximos de 38,30±27,13. Por último, para la variable actividad de la enfermedad generada para el estudio (una combinación de un DAS28 activo [≥3,2] en 2 visitas o una alta VSG [≥50] en 2 mediciones o un alto VSM [≥nivel moderado] en 2 visitas), encontramos un 26,14% de los pacientes con alta actividad y un 73,86% de los pacientes con baja actividad.
El 67,3% tomaron AINE durante el período de estudio y el 67,6% de los pacientes recibieron corticosteroides. Un 20,7% de los pacientes recibieron 2 o más DMARD simultáneamente durante los últimos dos años. Los DMARD administrados con mayor frecuencia durante el período de estudio fueron metotrexato (59,6%), seguido de leflunomida (22,1%), antimaláricos (12,2%) y sulfasalazina (3,1%). Un 36,95% de la muestra recibió algún tipo de tratamiento biológico durante el período de estudio. Los fármacos más ampliamente usados fueron adalimumab (27,3%), infliximab (20,5%), etanercept 50 (19,9%), etanercept 25 (12,2%) y rituximab (7,6%).
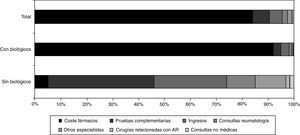
Los costes se calcularon de acuerdo con el valor monetario asignado a los servicios de salud según las distintas fuentes de datos consultadas. El coste médico directo total por paciente fue de 24.291±45.382€ en los 2 años del estudio. Los costes totales de medicamentos (FAME, biológicos, AINE, corticosteroides y analgésicos) fueron de 19.567±43.560€. Si se excluye el coste de los medicamentos biológicos, el coste medio por paciente es de 3.742±3.711€. La distribución de costes se muestra en la figura 1. Se encontraron diferencias en los costes por género, con un coste medio de 17.330±1.993€ para los hombres y de 26.814±1.720€ para las mujeres, con una diferencia estadísticamente significativa (p=0,002).
En cuanto a las diferencias entre los grupos, los pacientes que recibieron fármacos biológicos tenían un coste significativamente mayor para las siguientes variables: visitas al reumatólogo; visitas a la consulta de enfermería; cirugías ortopédicas sin prótesis; cirugías ortopédicas de la columna vertebral; consultas de servicios sociales; consultas de psicología; consultas de rehabilitación; hemograma; bioquímica; sedimento; electroforesis de proteínas; serología; cultivo; FR; VSG; PCR; anti-CCP; radiografía de tórax; radiografía ósea axial; resonancia magnética; Mantoux; pruebas de función pulmonar; artrocentesis, e ingreso en el hospital.
No hubo diferencias en los costes para las otras variables que se evaluaron. Aunque no resultó estadísticamente significativo, los pacientes que recibieron fármacos biológicos tenían un menor coste para las visitas a otros especialistas, pruebas de HLA-B27, radiografías abdominales, algunos otros tipos de radiografías y ecografía abdominal.
En el análisis de regresión lineal bivariado, se encontró que las variables asociadas a los costes médicos directos fueron el sexo —con mayores costes para las mujeres (p=0,002)—, la edad del paciente (p=0,00), la duración de la enfermedad (p=0,00), la actividad de la enfermedad (p=0,00) y el tratamiento con fármacos biológicos (p=0,00).
Posteriormente, se realizó un análisis de regresión multivariado con todas las variables que fueron significativas en el análisis bivariado y ajustado por las variables sociodemográficas (tabla 1). En el análisis de los predictores médicos de costes para el conjunto de la muestra, los factores predictores encontrados fueron los fármacos biológicos (p=0,00), la comorbilidad (p=0,00) y la edad del paciente (p=0,01).
Análisis de regresión lineal múltiple para los costes médicos directos en la población de pacientes con artritis reumatoide
| Pacientes con artritis reumatoide | ||||
|---|---|---|---|---|
| Coef β | Error estadístico | t | p | |
| Fármacos biológicos | 1,23 | 0,02 | 50,80 | 0,000 |
| Comorbilidad | 0,07 | 0,01 | 6,77 | 0,000 |
| Tiempo de evolución | 0,0009 | 0,001 | 0,72 | 0,474 |
| Edad del paciente | -0,002 | 0,0008 | –2,50 | 0,012 |
| Sexo del paciente | 0,04 | 0,025 | 1,59 | 0,112 |
| Actividad de la enfermedad | 0,01 | 0,025 | 0,64 | 0,524 |
| Constante | 3,40 | 0,05 | 59,61 | 0,000 |
En negrita, los valores estadísticamente significativos, es decir, los que presentan valores de p < 0.05.
Posteriormente se realizó un análisis bivariado para el análisis por subgrupos. Para el grupo de pacientes que no recibieron fármacos biológicos, las variables que se asociaron con los costes fueron la comorbilidad del paciente (p=0,00) y la edad del paciente (p=0,01). Para el grupo de pacientes que recibieron fármacos biológicos, las variables que se asociaron con costes fueron la duración de la enfermedad (p=0,02), el sexo del paciente —con mayores costes médicos directos para las mujeres (p=0,01)— y la actividad de la enfermedad (p=0,00).
Por último, se crearon 2 modelos de regresión multivariado, uno para cada grupo de pacientes, incluyendo las variables que resultaron estadísticamente significativas en el análisis bivariado. En el análisis de los predictores de los costes médicos directos en el grupo de pacientes que no recibieron fármacos biológicos durante el período de estudio, los factores predictores independientes encontrados fueron la comorbilidad (p=0,00) y la edad del paciente (p=0,02) (tabla 2). En el análisis de los predictores de los costes médicos directos en el grupo de pacientes que recibieron fármacos biológicos durante el período de estudio, los factores independientes encontrados fueron el sexo del paciente (p=0,03) y la actividad de la enfermedad (p=0,02) (tabla 3).
Análisis de regresión lineal múltiple para los costes médicos directos en pacientes sin fármacos biológicos
| Pacientes sin fármacos biológicos | ||||
|---|---|---|---|---|
| Coef β | Error estadístico | t | p | |
| Comorbilidad | 0,10 | 0,01 | 9,02 | 0,000 |
| Tiempo de evolución | 0,0005 | 0,001 | 0,38 | 0,704 |
| Edad del paciente | –0,002 | 0,0009 | –2,23 | 0,026 |
| Sexo del paciente | 0,006 | 0,027 | 0,23 | 0,821 |
| Actividad de la enfermedad | –0,03 | 0,031 | –1,11 | 0,269 |
| Constante | 3,40 | 0,06 | 55,39 | 0,000 |
En negrita, los valores estadísticamente significativos, es decir, los que presentan valores de p < 0.05.
Análisis de regresión lineal múltiple para los costes médicos directos en pacientes con fármacos biológicos
| Pacientes con fármacos biológicos | ||||
|---|---|---|---|---|
| Coef β | Error estadístico | t | p | |
| Comorbilidad | 0,009 | 0,02 | 0,45 | 0,654 |
| Tiempo de evolución | 0,001 | 0,002 | 0,56 | 0,573 |
| Edad del paciente | –0,002 | 0,001 | –1,67 | 0,096 |
| Sexo del paciente | 0,104 | 0,049 | 2,11 | 0,036 |
| Actividad de la enfermedad | 0,09 | 0,043 | 2,25 | 0,025 |
| Constante | 4,63 | 0,10 | 45,60 | 0,000 |
En negrita, los valores estadísticamente significativos, es decir, los que presentan valores de p < 0.05.
Este estudio retrospectivo calcula los costes directos a partir de los recursos utilizados por los pacientes. Los resultados de este trabajo proporcionan una amplia caracterización de los pacientes con AR en nuestro país, presentando una distribución por edad y sexo similar a otras series publicadas24, con una edad media de los pacientes algo mayor de 60 años, y un 26% de varones.
Los datos de costes (excluyendo fármacos biológicos), con una media de 3.742€ durante el período de estudio, son menores que en los pacientes de otros estudios, que tenían un coste anual alrededor de 3.980€25.
Parece claro que los fármacos biológicos suponen el grueso de estos costes médicos directos, aunque hay otros factores que influyen, como la actividad de la enfermedad, en el caso de los pacientes con biológicos. En el caso de los pacientes que no siguen tratamiento con fármacos biológicos, la edad y la comorbilidad son los grandes predictores del coste médico directo.
Algunos estudios muestran que el aumento del coste de tratamiento causado por la introducción de fármacos biológicos se ha ralentizado desde 200926 debido a que las tasas de prescripción están aumentando, pero de una manera más secuencial. Esto también ha ocasionado la optimización de los fármacos con protocolos menos estrictos que se adapten mejor a las características del paciente. Dada la tendencia a iniciar un tratamiento de forma temprana, se espera que los costes se estabilicen con el tiempo.
Parece claro que los costes médicos directos de los pacientes con AR han aumentado debido a la introducción de nuevos tratamientos, así como al aumento de la edad del paciente, que está aumentando en paralelo a la edad de la población general. Sin embargo, aunque este estudio no recogió los costes indirectos, otros estudios indican que estos están compensados por disminuciones en otros gastos. De hecho, un estudio reciente muestra un incremento continuo de los costes médicos anuales para los pacientes con AR que son tratados por reumatólogos alemanes entre 2002 y 2011, causados por el creciente uso de agentes biológicos. Sin embargo, el incremento fue parcialmente compensado por la disminución de los costes de ingresos en hospital, pérdida de trabajo y discapacidad, con una disminución de los días laborales perdidos y menos casos de discapacidad permanente27.
Al interpretar los resultados de este estudio, han de tenerse en cuenta algunas limitaciones. La duración de la recolección de datos fue solo de 2 años, por lo tanto, la interpretación de los resultados debe hacerse con precaución. Además, hay que tener en cuenta que algunos datos pueden no ser extraíbles de la historia clínica o no estar registrados, lo que influye en la validez de los resultados28. Igualmente, los datos de los costes no son exactos, sino más bien imputaciones a nivel nacional. Los costes por paciente pueden estimarse de forma incorrecta, sobre todo porque las diferencias por comunidad o centro no se tuvieron en cuenta. Es importante destacar que, debido al tipo de estudio, fue imposible recoger los costes indirectos asociados a la productividad laboral y otras causas. Por lo tanto, no hemos podido estimar el impacto en los costes indirectos que pueden haber resultado de un mejor manejo del tratamiento o de la introducción de fármacos biológicos, tal y como se ha visto en otros estudios.
En resumen, este estudio presenta un mapa detallado de los costes médicos directos para los pacientes con AR en España. Estos datos pueden contribuir a la comprensión y estimación de la repercusión económica de la enfermedad, a la comparación con los datos de otros marcos geográficos, al desarrollo de estrategias para la reducción de estos costes y al aumento de la calidad de la atención. En esta línea, las recomendaciones sobre optimización de fármacos y perfiles de tratamiento adaptados al paciente son de gran importancia, así como la posibilidad de contar con una consulta de enfermería para educar al paciente en su conocimiento de la enfermedad, reduciendo así consultas y pruebas innecesarias en muchos casos.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
FinanciaciónEl estudio EMAR-II ha sido promovido por la Sociedad Española de Reumatología y financiado por los laboratorios AbbVie.
Conflicto de interesesEl estudio EMAR-II estuvo financiado por los laboratorios Abbvie.
C. Escudero, N. Chozas, I. Maries, A. Fernandez, F. Medina, I. Ureña, V. Irigoyen, M. Lopez, P. Espiño, S. Manrique, E. Collantes, P. Font, D. Ruiz, M. Granados, M.J. Pozuelo, I. Moreno, J.M. Pina, R. Roselló, C. Vázquez, J. Beltrán, F.J. Manero-Ruiz, A. Pecondón, E. Giménez, F. Jimenez, J. Marzo, M. Medrano, J. Babío, T. Tinturé, S. González, C. Ordás, M.E. García, L. Espadaler, J. Fernandez, J. Fiter, A. Naranjo, S. Ojeda, J. Tornero, J.A. Piqueras, E. Júdez, C. López, J. Medina, G. Iglesias, M. Alvarez, J. Alegre, M.R. Colazo, J.L. Alonso, B. Alvárez, C. Montilla, S. Gómez, R. López, M. Sánchez, S. Castro, S. Ordóñez, D. Boquet, J. Calvet, D. de la Fuente, V. Rios, M. Nolla, A. Martínez-Cristóbal, R. Negueroles, M.L. Muñoz, J. García, F. Gamero, E. del Rincón, E. Pérez-Pampín, L. Fernandez, R. Miguélez, A.M. Ortíz, E. Vicente, S. Pérez Esteban, E. Tomero, A. Casado, M.J. Arias, E. Cuende, C. Bohorquez, J.M. Rodríguez, A. Aragón, J. García, J. Zubieta, A. Gallego, C. Martínez, I. Mateo, A. de Juanes, E. Enríquez, I. Monteagudo, F.J. López-Longo, E. Pagán, M.J. Rubira, P. Mesa, J. Galvez, E. Saiz, C. Tornero, E. Úcar, C. Rodríguez, B. González Álvarez, N. Rivera, F.X. Arasa, S. Bustabad, E. Delgado, J. Maese y R. Veroz.