El lupus eritematoso sistémico (LES) es una enfermedad crónica autoinmune que afecta a múltiples órganos y sistemas. Las células B tienen un papel crítico en la patogénesis del LES. El rituximab (RTX) es un fármaco compuesto por anticuerpos monoclonales quiméricos contra la proteína CD20, produciendo una depleción de linfocitos B.
ObjetivoAnalizar la efectividad y la seguridad de RTX en pacientes con LES en práctica clínica.
MétodosRecogida de variables retrospectiva de los historiales médicos de 20 pacientes con LES tratados con RTX en 2centros hospitalarios (Hospital de la Santa Creu i Sant Pau y Hospital del Mar, en Barcelona). Se evaluaron variables demográficas, clínicas, serológicas y de tratamiento.
ResultadosHubo asociación estadísticamente significativa entre las variables a estudio pre y postratamiento siguientes: descenso de SLEDAI (p<0,001), de VSG (p=0,017), en uso de glucocorticoides (p=0,025), de IgM (p=0,031) y aumento de C4 (p=0,014) tras el tratamiento con RTX. Un paciente con LES, síndrome antifosfolipídico, importante comorbilidad y afectación lúpica multiorgánica falleció tras un proceso séptico meses después de haber recibido un único ciclo de tratamiento con RTX.
ConclusionesA pesar de que actualmente RTX no tiene indicación aprobada en ficha técnica para LES, podemos indicar que es efectivo en cuanto a la reducción de la actividad de la enfermedad, ahorrador de corticoides y con un perfil de seguridad aceptable. Se necesitan mayor tiempo de seguimiento y mayor número de pacientes para resolver las dudas todavía existentes sobre el uso de RTX en LES.
Systemic lupus erythematosus (SLE) is a chronic autoimmune disease that affects multiple organs and systems. B cells have a critical role in the pathogenesis of SLE. Rituximab (RTX) is a drug composed of chimeric monoclonal antibodies against the CD20 protein, producing a depletion of B lymphocytes.
ObjectiveTo analyze the effectiveness and safety of RTX in patients with SLE in clinical practice.
MethodsCollection of retrospective variables of the medical records of 20 patients with SLE treated with RTX in 2hospitals (Hospital de la Santa Creu i Sant Pau, and Hospital del Mar, in Barcelona, Spain). We evaluated demographic, clinical, serological and treatment variables.
ResultsThere was a statistically significant association in the following variables collected in the study before and after treatment: there was a decrease in the Systemic Lupus Erythematosus Disease Activity Index (SLEDAI) (P<.001), erythrocyte sedimentation rate (P=.017), use of glucocorticoids (P=.025) and IgM values (P=.031), as well as an increase in the C4 values (P=.014) after treatment with RTX. A patient with SLE, antiphospholipid syndrome, complex comorbidity and multiorgan lupus involvement died after developing a septic process, months after receiving a single treatment cycle with RTX.
ConclusionsAlthough RTX currently has no official indication approved for SLE, our data suggest that it may be effective in reducing the activity of the disease and as a steroid-sparing agent, with an acceptable safety profile. However, larger follow-up periods with a greater number of patients are needed to solve the remaining doubts about the use of RTX in SLE.
El lupus eritematoso sistémico (LES) es una enfermedad crónica autoinmune heterogénea caracterizada por la posible afectación de múltiples órganos y sistemas1. En España su prevalencia se estima en 9 de cada 10.000 habitantes2. Aunque su pronóstico ha mejorado en los últimos años, la calidad de vida del paciente con LES es claramente inferior a la de la población general3 y la mortalidad es de 2 a 3 veces mayor4. En España existen pocos estudios sobre pacientes con LES que aporten datos consistentes, bien por su carácter local, por el limitado tamaño muestral o debidos a períodos de seguimiento muy cortos5.
Las células B tienen un papel crítico en la patogénesis del LES, incluyendo la producción de citocinas, la presentación de autoantígenos, la activación de células T y la producción de autoanticuerpos. La pérdida de tolerancia de las células B puede ser un elemento esencial en la patogénesis del LES, siendo esta una fuerte justificación para el estudio de tratamientos dirigidos a modificar los efectos de las células B en la inmunidad6.
El rituximab (RTX) es un medicamento compuesto por anticuerpos monoclonales quiméricos contra la proteína CD20, la cual se encuentra principalmente en la superficie de los linfocitos B7. Este fármaco produce una depleción de linfocitos B con potencial efecto en enfermedades inmunomediadas caracterizadas por un exceso de colonias de células B, células B hiperactivas o células B disfuncionales8. Hasta la fecha, únicamente se han publicado 2ensayos clínicos controlados que han evaluado la eficacia y seguridad del RTX en LES moderado-grave (EXPLORER) y LES con nefritis lúpica activa (LUNAR), sin que ambos detectaran diferencias significativas de RTX comparado con placebo tras un año de tratamiento9,10. A pesar de ello, hay publicadas series de pacientes en las que el RTX para LES proporciona beneficio en casos refractarios a los tratamientos convencionales11-13.
Presentamos una serie de pacientes con LES tratados con RTX en 2centros de una misma área urbana con el objetivo de analizar las características clínicas de los pacientes tratados y evaluar su efectividad y seguridad.
MétodosPacientesEste estudio es un estudio observacional retrospectivo en forma de series de casos. Los casos se obtuvieron de pacientes con LES que acudían regularmente a las consulta externas de Reumatología, consulta monográfica de Lupus y Hospital de día de Reumatología de 2centros de Cataluña (España), entre marzo del 2007 y septiembre del 2015 en el Hospital de la Santa Creu y Sant Pau y el Hospital del Mar/Parc de Salut Mar-IMAS de Barcelona. Los pacientes debían cumplir al menos 4de los 11 criterios de clasificación para LES del American College of Rheumatology de 199714. La recopilación de datos de los pacientes se llevó a cabo de acuerdo con lo acordado en la Declaración de Helsinki.
VariablesSe recogieron las variables sociodemográficas: edad, sexo, duración de la enfermedad; clínicas: actividad (SLEDAI15) antes y después del tratamiento con RTX (1g/iv en los días 1 y 15, administrado cada 6 meses por protocolo); serológicas: anticuerpos anti-ADNdc (0-300 UI/ml Hospital del Mar; 1/10 UI Hospital de la Santa Creu i Sant Pau), velocidad de sedimentación globular (VSG) (0-37mm/h ambos centros), proteína C reactiva (0-0,8mg/dl ambos centros), complemento C3 (0-90mg/dl) (85-193mg/dl) y C4 (0-10mg/dl) (12-36mg/dl), niveles de inmunoglobulinas IgA, IgG, IgM (IgA 70-400mg/dl, IgG 700-1.600mg/dl, IgM 40-230mg/dl) (IgA 69-382mg/dl, IgG 723-1.685mg/dl, IgM 40-230mg/dl), fórmula leucocitaria (leucocitos 4,49-12,68×10E9/l, neutrófilos 2,10-8,89×10E9/l, linfocitos 1,26-3,35×10E9/l) (leucocitos 3,80-11,00×10E9/l, neutrófilos 1,80-7,00×10E9/l, linfocitos 1,00-4,00×10E9/l), depleción total de linfocitos B (CD 19<1%), dosis de prednisona (mg/día), y de tratamiento: número de ciclos de RTX recibidos en cada paciente durante el seguimiento. Se recogieron datos sobre los efectos adversos, infecciones graves (definidas estas como aquellas infecciones que requieren un ingreso hospitalario o medicación por vía intravenosa) y defunciones.
Análisis estadísticoSe analizaron los datos pre (inmediatamente antes de la administración de un nuevo ciclo de RTX) y posciclo de tratamiento con RTX (a los 3meses de la administración del tratamiento), describiéndose las variables categóricas con frecuencias y porcentajes y las variables continuas con la mediana y los percentiles 25 y 75. La asociación entre las variables clínicas antes y después del tratamiento con RTX se evaluó mediante el test de la chi al cuadrado de Pearson o Mcnemar, según correspondía para las variables categóricas, y la prueba de U-Mann-Whitney para las variables continuas. Todos los análisis fueron de 2colas, y los valores de p se consideraron significativos si p<0,05. Debido a las diferentes unidades y rangos de normalidad de los 2 centros para los datos de las variables: anti-ADNdc, C3, C4, inmunoglobulinas IgA, IgG, IgM y fórmula leucocitaria de los pacientes de ambos centros, solo tuvieron en cuenta resultados superiores, inferiores o dentro del rango de normalidad, sin incluir el valor numérico exacto de cada variable en el análisis. Consecuentemente, nos vimos obligados a tratar estas variables continuas como categóricas en el para poder analizar los resultados conjuntamente de ambos centros. Los análisis estadísticos se realizaron con el software informático SPSS 18.0 (IBM Inc., SPSS Inc. Released 2009. PASW Statistics for Windows, Version 18.0. Chicago: SPSS Inc.).
ResultadosSe incluyó a un total de 20 pacientes, 16 mujeres y 4 varones, con una edad media de 43,9±15,8 años, con un tiempo de seguimiento desde el diagnóstico de LES hasta el comienzo de tratamiento con RTX de 10,9±8,8 años, y recibieron una media de 3,5±1,7 ciclos de RTX. De los 20 pacientes, las manifestaciones resistentes a tratamiento inmunosupresor convencional y por las que se indicó tratamiento con RTX fueron: artritis (n=10), nefropatía (n=8), afectación hematológica (n=6), cutánea (n=5), pericarditis (n=3), pulmón encogido (n=1) y afectación del sistema nervioso central (n=1). Los fármacos inmunosupresores que habían recibido previamente y a los que no habían presentado respuesta fueron: micofenolato de mofetilo (MMF) (n=8), cloroquina (n=6), azatioprina (n=9), ciclofosfamida (n=5), hidroxicloroquina (n=8) y metotrexato (n=3). De los 20 pacientes, se monitorizó la depleción de linfocitos B (% CD 19 a los 3 meses de la perfusión) a 15 pacientes. De esos 15 pacientes, 8 presentaron una depleción total de linfocitos B (CD 19<1%).
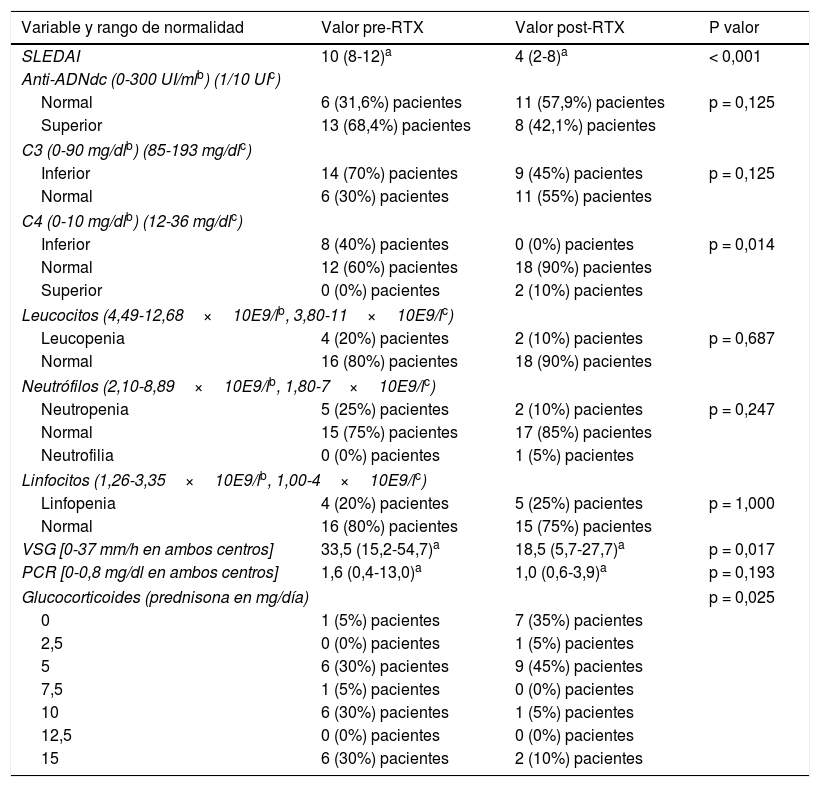
Hubo asociación estadísticamente significativa entre las variables a estudio pre y postratamiento siguientes: descenso de SLEDAI de una media de 10 (8-12) (p25-p75) a 4 (2-8) puntos (p<0,001), descenso de VSG de una media de 33,5 (15,2-54,7) a 18,5 (5,7-27,7) (p=0,017), descenso en el uso de glucocorticoides donde previamente al tratamiento un 65% de los pacientes tomaban dosis mayores de 5mg/día y después del tratamiento el 85% de los pacientes tomaban dosis menores o iguales a 5mg/día (p=0,025), descenso de IgM pasando de 1 a 7 pacientes con valores inferiores a los rangos de normalidad (p=0,031) y aumento de C4 con un 100% de pacientes con valores normales o superiores de C4 tras el tratamiento con RTX (p=0,014) (tabla 1). No hubo una reducción significativa del nivel plasmático del anticuerpos anti-DNAdc, pero sí se encontró una tendencia a la reducción (disminuyó en 8 de los 13 pacientes en los que se presentaba elevado antes del tratamiento con RTX) (p=0,125). Para los resultados de las variables categóricas de la tabla 1 que indican «inferior», «superior» o «normal», hacen referencia a cuántos pacientes en porcentaje se encuentran con valores por debajo, por encima o dentro, en función del rango de normalidad de cada variable, respectivamente.
Asociaciones entre el tratamiento con RTX y las diferentes variables pre y postratamiento de los pacientes con LES de ambos centros
| Variable y rango de normalidad | Valor pre-RTX | Valor post-RTX | P valor |
|---|---|---|---|
| SLEDAI | 10 (8-12)a | 4 (2-8)a | < 0,001 |
| Anti-ADNdc (0-300 UI/mlb) (1/10 UIc) | |||
| Normal | 6 (31,6%) pacientes | 11 (57,9%) pacientes | p = 0,125 |
| Superior | 13 (68,4%) pacientes | 8 (42,1%) pacientes | |
| C3 (0-90 mg/dlb) (85-193 mg/dlc) | |||
| Inferior | 14 (70%) pacientes | 9 (45%) pacientes | p = 0,125 |
| Normal | 6 (30%) pacientes | 11 (55%) pacientes | |
| C4 (0-10 mg/dlb) (12-36 mg/dlc) | |||
| Inferior | 8 (40%) pacientes | 0 (0%) pacientes | p = 0,014 |
| Normal | 12 (60%) pacientes | 18 (90%) pacientes | |
| Superior | 0 (0%) pacientes | 2 (10%) pacientes | |
| Leucocitos (4,49-12,68×10E9/lb, 3,80-11×10E9/lc) | |||
| Leucopenia | 4 (20%) pacientes | 2 (10%) pacientes | p = 0,687 |
| Normal | 16 (80%) pacientes | 18 (90%) pacientes | |
| Neutrófilos (2,10-8,89×10E9/lb, 1,80-7×10E9/lc) | |||
| Neutropenia | 5 (25%) pacientes | 2 (10%) pacientes | p = 0,247 |
| Normal | 15 (75%) pacientes | 17 (85%) pacientes | |
| Neutrofilia | 0 (0%) pacientes | 1 (5%) pacientes | |
| Linfocitos (1,26-3,35×10E9/lb, 1,00-4×10E9/lc) | |||
| Linfopenia | 4 (20%) pacientes | 5 (25%) pacientes | p = 1,000 |
| Normal | 16 (80%) pacientes | 15 (75%) pacientes | |
| VSG [0-37 mm/h en ambos centros] | 33,5 (15,2-54,7)a | 18,5 (5,7-27,7)a | p = 0,017 |
| PCR [0-0,8 mg/dl en ambos centros] | 1,6 (0,4-13,0)a | 1,0 (0,6-3,9)a | p = 0,193 |
| Glucocorticoides (prednisona en mg/día) | p = 0,025 | ||
| 0 | 1 (5%) pacientes | 7 (35%) pacientes | |
| 2,5 | 0 (0%) pacientes | 1 (5%) pacientes | |
| 5 | 6 (30%) pacientes | 9 (45%) pacientes | |
| 7,5 | 1 (5%) pacientes | 0 (0%) pacientes | |
| 10 | 6 (30%) pacientes | 1 (5%) pacientes | |
| 12,5 | 0 (0%) pacientes | 0 (0%) pacientes | |
| 15 | 6 (30%) pacientes | 2 (10%) pacientes | |
| IgA (70-400 mg/dlb, 69-382 mg/dlc) | |||
| Inferior | 3 (15,8%) pacientes | 2 (10,5%) pacientes | p = 0,368 |
| Normal | 13 (68,4%) pacientes | 15 (78,9%) pacientes | |
| Superior | 3 (15,8) pacientes | 2 (10,5%) pacientes | |
| IgM (40-230 mg/dlb, 0-230 mg/dlc) | |||
| Inferior | 1 (5,3%) pacientes | 7 (36,8%) pacientes | p = 0,031 |
| Normal | 18 (94,7%) pacientes | 12 (63,2%) pacientes | |
| IgG (700-1.600 mg/dlb, 723-1.685 mg/dlc) | |||
| Inferior | 0 (0%) pacientes | 1 (5,3%) pacientes | p = 0,135 |
| Normal | 10 (52,6%) pacientes | 12 (63,1%) pacientes | |
| Superior | 9 (47,4%) pacientes | 6 (31,5%) pacientes | |
Un paciente con LES, síndrome antifosfolipídico, importante comorbilidad (hipertenso, dislipidémico, diabético, antecedentes cardiopatía isquémica, polimedicado) y afectación lúpica multiorgánica falleció tras un proceso séptico meses después de haber recibido un único ciclo de tratamiento con RTX. En cuanto al resto de los pacientes, no se hallaron, durante el seguimiento, mayor incidencia de infecciones graves ni de mortalidad.
DiscusiónTras la experiencia de 2centros se han obtenido resultados significativos a favor del uso de RTX en LES refractario a terapia convencional en cuanto a efectividad expresada como reducción en cifra de SLEDAI tras el tratamiento, acorde con algunas de las experiencias previas publicadas13,16,17.
Hasta la fecha, solo ha habido 2 ensayos clínicos controlados que han evaluado la eficacia y la seguridad del uso de RTX en LES, los estudios LUNAR9 y EXPLORER10. En total, se incluyó a 401 pacientes, sin poder llegarse a demostrar la eficacia de RTX al compararla con el grupo control. Es de destacar que los pacientes seleccionados en los 2ensayos mantuvieron el régimen de tratamiento inmunosupresor prescrito con anterioridad. En el estudio LUNAR se comparó la respuesta en pacientes afectados de nefritis lúpica tratados con glucocorticoides y MMF aleatorizados a placebo o RTX, objetivándose una respuesta renal parcial, aunque no completa9. En el estudio EXPLORER, el grupo de RTX no presentó respuesta British Isles Lupus Assessment Group (BILAG)18 significativa frente al grupo placebo tratados con AZA, MMF y glucocorticoides10. En ambos estudios se comparó RTX vs. placebo en pacientes en tratamiento con inmunosupresores y glucocorticoides, lo que podría haber minimizado las diferencias en cuanto a los resultados en eficacia12. Además, se midió la actividad del LES con índices más sencillos que en otros ensayos clínicos aleatorizados, como por ejemplo en el estudio de eficacia del belimumab, el estudio BLISS, en el que se utilizó un índice de actividad compuesto llamado SLE Responder Index (SRI)19. Por tanto y, pese a no haber demostrado un claro efecto positivo añadido al tratamiento con MMF en ensayos clínicos, RTX puede ser un fármaco eficaz en el control de pacientes refractarios a tratamiento inmunosupresor habitual, especialmente ciclofosfamida y MMF.
Que el RTX es efectivo en el tratamiento del LES tanto para las manifestaciones extrarrenales como para las renales parece cada vez más evidente. Hay numerosas series y registros que han demostrado su eficacia en el tratamiento del LES como son el registro UK-Biogeas11, el BILAG-BR20, el estudio LESIMAB12 y el registro francés AIR13, donde los resultados para eficacia varían desde el 49-71% de respuesta completa a los 6 meses en el global de manifestaciones de la enfermedad.
Si evaluamos los resultados de los diferentes estudios por lo que respecta a afectación de órganos y aparatos, podemos enumerar los beneficios de RTX en distintas afectaciones del LES. En la cohorte LESIMAB el 93% de los pacientes que presentaban artritis activa al iniciar el tratamiento respondieron a RTX12; una revisión de 100 pacientes tratados con RTX también observó esta eficacia de RTX a nivel articular21, y también encontramos datos favorables en el tratamiento de la artritis en el registro AIR13. Sobre la afectación del sistema nervioso central, la experiencia con RTX es escasa y se limita a varias series de casos publicadas22. Los resultados en el tratamiento de afectación hematológica también han sido positivos, sobre todo en trombocitopenias17,21. En cuanto a nefropatía, hay una amplia evidencia sobre a su efectividad23,24, e incluso las nuevas tendencias instan a investigar el cese en el uso de glucocorticoides en el tratamiento de mantenimiento de esta afectación. El régimen de tratamiento descrito es «rituxilup», en el que se demuestra en 50 pacientes que el uso del régimen de tratamiento consistente en 2 dosis de RTX (1g/iv) asociado a metilprednisolona (500mg/iv) en los días 1 y 15, y tratamiento de mantenimiento con MMF oral en pacientes con nefropatía, permite evitar los glucocorticoides en el tratamiento de mantenimiento25.
Por todo esto, RTX debe reservarse para pacientes con actividad moderada o grave y respuesta insuficiente, o pacientes resistentes al tratamiento estándar con glucocorticoides e inmunosupresores.
La necesidad de dosis altas de glucocorticoides para mantener el control de la enfermedad también podría constituir otra posible indicación26. En nuestro estudio se han obtenido resultados significativos en cuanto a reducción de dosis media de corticoides pre y postratamiento, al igual que han observado otras series13,17,20,27,28, dato importante ya que se evitarían los efectos secundarios de los glucocorticoides a altas dosis en el durante largos períodos.
Otros datos que apoyan que RTX disminuye la actividad inflamatoria en LES es la obtención en nuestro trabajo de resultados significativos en la reducción de la VSG pre y postratamiento, así como el aumento de C4. Por lo que respecta a los valores de anti-DNAdc, no se halló una reducción significativa del nivel plasmático pre y postratamiento, pero sí que hubo una tendencia a la reducción (disminuyó en 8 de los 13 pacientes en los que se presentaba elevado antes del tratamiento con RTX), algo que se ha evidenciado previamente en otras series publicadas9,11.
En referencia a la seguridad, no hay grandes series sobre fármaco-vigilancia y gestión del riesgo en LES pero se ha visto que el uso de RTX es seguro durante al menos 6-12 meses29. Está ampliamente documentado que el tratamiento repetido con RTX induce hipogammaglobulinemia30. Las consecuencias de una hipogammaglobulinemia mantenida con el uso repetido de RTX todavía se desconocen. En nuestra cohorte de pacientes hubo relación significativa para el descenso de IgM pre y postratamiento, sin haber podido relacionarse con ningún tipo de proceso infeccioso. Asimismo, no se encontraron efectos adversos graves, así como ningún caso de hepatitis B en nuestra serie. En cuanto a las defunciones, un paciente con LES y síndrome antifosfolipídico con pluripatología y afectación multiorgánica falleció por un proceso séptico meses después del tratamiento con RTX.
Como marcador de respuesta al tratamiento con RTX se han monitorizado los niveles de células B en nuestro estudio, como se ha realizado tradicionalmente en pacientes con artritis reumatoide tratados con RTX8. De los 20 pacientes, se monitorizó la depleción de linfocitos B (porcentaje de CD 19 a los 3 meses de la perfusión) en 15. De esos 15 pacientes, 8 presentaron una depleción total de linfocitos B (CD 19<1%).
Algunas cuestiones quedan sin resolver, como por ejemplo si se debe mantener la terapia inmunosupresora previa o el número de ciclos de RTX que se deben pautar tras iniciar el tratamiento. En general, se aconseja mantener la terapia inmunosupresora previa en aquellos pacientes en los que se ha hallado una respuesta insuficiente, pero hay que prestar especial atención al riesgo-beneficio del uso combinado de ciertos inmunosupresores, ya que hay un elevado riesgo de toxicidad, como por ejemplo con la combinación RTX-CFM. En ausencia de actividad lúpica, no se recomienda la administración sistemática de nuevos ciclos de RTX, salvo en pacientes con brotes particularmente graves de enfermedad26.
Las principales limitaciones del estudio han sido el escaso tamaño muestral, las diferencias entre centros, la recogida de datos, los diferentes rangos de normalidad y las unidades de cada variable según el centro de donde provenían, comportando todo ello la consecuente pérdida de validez interna y externa.
En conclusión, y a pesar de que actualmente RTX no tiene indicación aprobada en ficha técnica para LES, tras los resultados de nuestro estudio podemos indicar que es efectivo en cuanto a la reducción de algunas medidas de actividad y como ahorrador de glucocorticoides. En cuanto a la seguridad, en nuestra serie hubo una muerte en un paciente complejo con gran actividad del LES y síndrome antifosfolipídico secundario, pero el uso de RTX presentó una seguridad aceptable en el resto de los pacientes. Se necesita un mayor tiempo de seguimiento y con mayor número de pacientes para poder resolver las dudas todavía existentes sobre el uso de RTX en LES.
Conflicto de interesesLos autores declaran no tener ningún conflicto de interés para la realización de este trabajo.