Se presenta un caso de enteropatía perdedora de proteínas (EPP)como manifestación inicial del lupus eritematoso sistémico (LES). Se trata de una paciente de sexo femenino, de 17 años de edad, que consulta por síndrome ascítico edematoso e hipoalbuminemia. El diagnóstico de LES se estableció por la presencia de: rash malar, úlceras orales, trombocitopenia, anticuerpos antinucleares, anticardiolipinas IgM y anticoagulante lúpico positivos. Se descartó el compromiso renal y hepático como causa de hipoproteinemia. El diagnóstico de la pérdida enteral de proteínas se realizó con el Clearance de alfa 1 antitripsina. La EPP fue refractaria a distintas líneas de inmunosupresores, como corticoides, ciclofosfamida, azatioprina y ciclosporina, presentando respuesta satisfactoria y sostenida a rituximab, lo que posibilitó la reducción de corticoides y la remisión de la enfermedad por tiempo prolongado.
A case is presented of a protein-losing enteropathy (PLE) as the initial manifestation of systemic lupus erythematosus (SLE) in a 17 year-old female patient, who presented with ascites, edema and hypoalbuminemia. The diagnosis of SLE was based on the presence of: malar rash, oral ulcers, thrombocytopenia, antinuclear antibodies, IgM anticardiolipin antibody, and lupus anticoagulant. Renal and liver diseases were ruled out. The PLE diagnosis was confirmed with fecal alpha 1-antitrypsin clearance. The PLE was refractory to different lines of immunosuppressive agents like glucocorticoids, cyclophosphamide, azathioprine, and cyclosporine, showing a satisfactory and sustained response with rituximab, allowing steroid sparing and long term remission.
Las manifestaciones gastrointestinales son frecuentes en el LES. Síntomas inespecíficos, como anorexia, náuseas, vómitos y diarrea, se observan hasta en un tercio de los pacientes con enfermedad activa. La ascitis, la enfermedad ulcerosa péptica y la disfagia presentan una frecuencia del 8-12, el 6 y el 1-7,3%, respectivamente. El dolor abdominal, presente en el 8-37% de los pacientes, puede ser la manifestación de una complicación como la vasculitis mesentérica o bien atribuirse a causas no relacionadas con el lupus, como el síndrome de intestino irritable1. La enteropatía perdedora de proteínas (EPP) es una manifestación clínica infrecuente asociada al LES, siendo en algunos casos la primera manifestación2. La prevalencia es de alrededor del 2-3%3,4. Se caracteriza por presentar hipoalbuminemia secundaria a la pérdida de proteínas a través del tracto gastrointestinal. Presentamos el caso de una paciente con LES asociada a EPP refractaria al tratamiento inmunosupresor convencional con respuesta satisfactoria a rituximab (RTX).
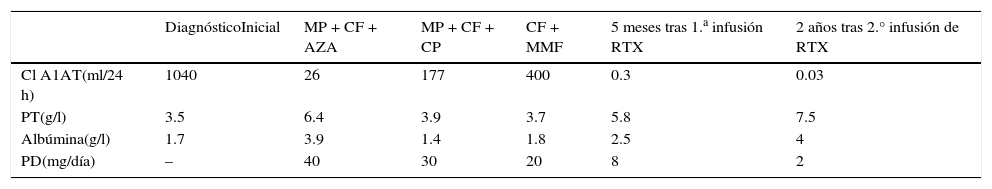
Caso clínicoMujer de 17 años de edad, que ingresa al hospital para el estudio de ascitis de reciente comienzo. Manifestaba episodios de dolor abdominal crónico y diarrea de 3 años de evolución. En el examen físico presentaba rash malar, poliartritis, alopecia, úlceras orales, anasarca y derrame pleural. La analítica destacaba: hemoglobina 11g/dl, plaquetas 67.000/mm3, proteínas totales 35g/l, albúmina 17g/l, triglicéridos 800mg/dl, velocidad de sedimentación globular 120mm/1 h, C3: 58mg/dl (90-180mg/dl), C4: 13mg/dl (10-40mg/dl), sedimento urinario normal y proteinuria negativa en orina de 24 h. Los anticuerpos antinucleares (1/640 patrón moteado grueso), anti-DNA, anti-Sm, anti-Ro y anti-La, fueron negativos; la anticardiolipinas IgM 36 UMPL/ml (valor de referencia [VR] 15-20) y el anticoagulante lúpico resultaron positivos. Se diagnosticó LES en base a los criterios del American of College Rheumatology 1982. Se descartó compromiso renal y hepático como causa de la hipoproteinemia. Los exámenes de coprocultivo, coproparasitológico, antitransglutaminasa IgA/IgG, antipéptidos deaminados de gliadina IgG/IgA y antiendomisio IgA fueron negativos. En el estudio de materia fecal, el Clearance de alfa 1-antitripsina (Cl A1AT) fue de 1.040ml/24 h (VR < 30ml/24 h). Se realizó una videoendoscopia digestiva alta que informó segunda porción duodenal con marcado edema que condicionaba engrosamiento de pliegues duodenales. Las biopsias de duodeno demostraron duodenitis crónica inespecífica con conservación de la relación criptovellositaria y edema coriónico. En la videocolonoscopia no se encontraron lesiones y las biopsias mostraron cambios inespecíficos. Se diagnosticó EPP asociada al LES y se inició tratamiento con metilprednisolona (MP) por vía intravenosa (iv) en pulsos de 1g durante 3 días, ciclofosfamida (CF) 500mg quincenal por 6 dosis, seguido por azatioprina (AZA) 150mg/día e hidroxicloroquina 400mg/día, con una pauta de descenso de corticoides hasta 20mg/día. A los 2 meses de inicio del tratamiento, se logró la remisión y se mantuvo asintomática durante 24 meses, durante el cual la paciente continuaba con AZA 150mg/día como tratamiento de mantenimiento. En la tabla 1 se muestran los parámetros de laboratorio y respuesta al tratamiento.
Evolución de parámetros de laboratorio y tratamiento
| DiagnósticoInicial | MP + CF + AZA | MP + CF + CP | CF + MMF | 5 meses tras 1.a infusión RTX | 2 años tras 2.° infusión de RTX | |
|---|---|---|---|---|---|---|
| Cl A1AT(ml/24 h) | 1040 | 26 | 177 | 400 | 0.3 | 0.03 |
| PT(g/l) | 3.5 | 6.4 | 3.9 | 3.7 | 5.8 | 7.5 |
| Albúmina(g/l) | 1.7 | 3.9 | 1.4 | 1.8 | 2.5 | 4 |
| PD(mg/día) | – | 40 | 30 | 20 | 8 | 2 |
AZA: azatioprina; CF: ciclofosfamida; Cl A1AT: Clearance de alfa 1-antitripsina; CP: ciclosporina; MMF: mofetil micofenolato; MP: metilprednisolona pulsos; RTX: rituximab; PD: prednisona; PT: proteínas totales (normal: 60-80).
A los 24 meses presenta su primer recaída, con síndrome ascítico edematoso (SAE), sin otras manifestaciones clínicas de actividad de LES. En la analítica presentaba niveles de C3 disminuidos, por lo que se indicó nuevamente iniciar MP en pulsos iv de 1g durante 3 días consecutivos y CF iv en dosis de 1g/mes. Continuó con ciclosporina 200mg/día como terapia de mantenimiento. Esta última debió suspenderse por intolerancia gastrointestinal. La paciente presentaba reactivación de los síntomas tras el descenso de prednisona por debajo de 30mg/día. Como complicación de la corticoterapia prolongada, desarrolló necrosis ósea avascular en ambas rodillas.
Al año presentó una segunda recaída con SAE, sin otros síntomas de actividad del LES, por lo que recibió nuevamente CF 500mg iv quincenal por 6 dosis. Quince meses después presentó una nueva recidiva, con marcado deterioro del estado nutricional; la paciente se encontraba con corticoides en dosis de 20mg/día. Inició alimentación parenteral y tratamiento con mofetil micofenolato (MMF) 3g/día durante 3 meses. Ante falta de respuesta clínica y analítica, se indicó RTX 375mg/m2/semanal por 4 dosis asociado a 2g de MMF, alcanzando la remisión completa 5 meses después.
Ante la severidad de la enfermedad y la refractariedad a los diversos inmunosupresores, se decide pautar una nueva dosis de RTX a los 6 meses. No se realizó monitorización de linfocitos CD19. En la actualidad, lleva 2 años de remisión del LES y de la EPP, en tratamiento con prednisona 2mg/día y MMF 1g/día. No se detectó durante el seguimiento ningún efecto adverso relacionado a RTX.
DiscusiónLa EPP es una entidad asociada a pérdida de proteínas a través del tracto gastrointestinal. Clínicamente, se manifiesta con dolor abdominal, diarrea de intensidad variable y edemas periféricos. La hipoalbuminemia con proteinuria negativa es el hallazgo más frecuente5. Se puede asociar a una gran variedad de desórdenes, tales como: enfermedad inflamatoria intestinal, tuberculosis, linfoma, linfangiectasia, enfermedad de Whipple, enfermedad celíaca, amiloidosis y enfermedades autoinmunes.
La EPP es una manifestación infrecuente en el LES. En una serie de casos de 15 pacientes con LES del Hospital de Pekín Union Medical College, el 53% de los pacientes presentó EPP como manifestación inicial del LES, presentando solo el 40% diarrea y dolor abdominal. La mayoría presentó algún grado de edema periférico: ascitis (73%), derrame pleural (60%), y derrame pericárdico (47%). Todos los pacientes tenían hipoalbuminemia, hipocomplementemia (80%), dislipidemia (67%) e hipocalcemia (40%)6. Si bien la causa es desconocida, existen varios mecanismos patogénicos propuestos: injuria vascular mediada por complemento, vasculitis mesentérica no necrosante, linfangiectasia adquirida y aumento de la permeabilidad microvascular intestinal mediada por interferón gamma, interleucina-6, factor de necrosis tumoral alfa y otras citocinas7-11.
El diagnóstico de EPP se realiza mediante la combinación de las manifestaciones clínicas, demostración de la pérdida de proteínas a través del tracto gastrointestinal mediante centellografía con albúmina marcada con TC-99, el Cl A1AT en materia fecal, la respuesta al tratamiento y la exclusión de otras causas de hipoalbuminemia2. La centellografía con TC-99 es el estudio de elección para el diagnóstico, ya que presenta alta sensibilidad (el 100 vs. el 46%) y alto valor predictivo negativo (el 100 vs. el 63%) comparado con el Cl A1AT. Por otro lado, permite detectar la localización de la pérdida enteral12,13. En el caso descrito, no se realizó la centellografía con TC-99 por falta de disponibilidad. Utilizamos el Cl A1AT, que nos permite realizar seguimiento y evaluar la respuesta al tratamiento.
En una revisión sistemática, se registraron 112 pacientes con EPP asociada a LES, de los cuales el 42% respondió a terapia con esteroides y el 66% requirió otro inmunosupresor el cual incluyó en el 46% la CF, en el 33% la AZA y en el 7% la combinación de AZA con CF5. En cuanto a la indicación de RTX, hasta el momento solo se ha reportado un caso de EPP asociado a síndrome de Sjögren, con buena respuesta al mismo14.
El RTX es un anticuerpo monoclonal dirigido contra el antígeno CD20 de los linfocitos B. A pesar de que no existen trabajos clínicos aleatorizados controlados que demuestren el beneficio de RTX en el LES, existe evidencia de su eficacia en estudios observacionales y casos reportados. En todos los casos, el tratamiento se indicó en formas refractarias, definidas como pacientes que no alcanzaban la remisión o presentaban recaídas de la enfermedad a pesar de una dosis óptima de corticoides y falla en al menos 2 inmunosupresores. Ramos-Casals et al. analizaron la eficacia off-label de RTX en pacientes con LES y encontraron una respuesta superior al 80% en nefritis proliferativas, compromiso neurológico y hematológico (anemia hemolítica y trombocitopenia); por el contrario, la tasa de respuesta fue menor del 50% en manifestaciones cutáneas y articulares. A su vez, permitió disminuir la dosis de esteroides en el 79% y suspender los mismos en el 14%15,16.
En conclusión, la EPP es una complicación infrecuente del lupus que debiera sospecharse en pacientes que presentan hipoalbuminemia persistente, edemas periféricos, derrame pleural y ascitis luego de excluir principalmente enfermedad renal y hepática. El tratamiento con RTX debiera considerarse en forma temprana ante el fracaso a un segundo inmunosupresor, evitando probablemente el desarrollo de daño irreversible relacionado con la corticoterapia.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.