Describir los resultados del estudio comparativo entre las 2 versiones de un inmunoanálisis comercializado para la monitorización terapéutica de adalimumab (ADA) en artritis reumatoide (AR).
Material y métodosSe han analizado 140 muestras de suero de pacientes con AR tratados con ADA 40mg cada 14 días con las 2 versiones del ensayo (V1 o anterior y V2 o actualizada).
ResultadosSe obtuvo una buena correlación con las dos versiones. En general, V2 proporciona resultados más altos de concentración de ADA que V1 y presenta una mayor precisión en el rango de concentraciones próximas al nivel de decisión clínica, ajustándose más a la concentración real del fármaco en sangre. Además, permite la automatización completa, lo cual simplifica mucho el análisis, y reduce significativamente la variabilidad.
ConclusiónLa monitorización de ADA con la versión actualizada demostró tener ventajas técnicas significativas, pudiendo ser una herramienta más práctica para la toma de decisiones terapéuticas en pacientes con AR.
To describe the results of the comparative study between both versions of an immunoassay commercialized for therapeutic drug monitoring of adalimumab (ADA) in rheumatoid arthritis (AR).
Material and methods140 samples of patients with RA treated with ADA 40mg every 14 days were analyzed by both versions of the test (V1 or previous and V2 or updated).
ResultsA good correlation was obtained by both versions. In general V2 provides higher results of ADA's concentration than V1 and presents greater precision in the range of concentrations for clinical decisions, adjusting for the real concentration of the drug in blood. In addition, V2 allows for complete automation, which simplifies the analysis and reduces significantly the variability.
ConclusionADA's monitoring with the updated version demonstrated to have technical significant advantages, constituting a more practical tool for therapeutic decisions in patients with RA.
Adalimumab (ADA; Humira®, Abbott Laboratories, North Chicago, Illinois, EE. UU.) es un anticuerpo monoclonal completamente humano que se une específicamente al factor de necrosis tumoral α (TNF-α), neutralizando su función biológica y modulando la respuesta inducida por este. A pesar de su eficacia ampliamente demostrada en las diferentes indicaciones clínicas aprobadas, algunos pacientes no responden o presentan una pérdida de respuesta en el tiempo. Una posible explicación sería que, en estado estacionario, no se alcancen concentraciones séricas de ADA necesarias para garantizar su eficacia. En algunos casos este hecho se ha relacionado con la presencia de anticuerpos anti-ADA, que forman complejos con ADA aumentando su depuración1,2. Por otro lado, la cuantificación de niveles terapéuticos de ADA al final del intervalo posológico en pacientes no respondedores aporta una valiosa información orientando en la posterior selección del nuevo tratamiento3. Además, el desarrollo de curvas dosis-respuesta permite guiar el espaciamiento de dosis de este fármaco en pacientes en remisión clínica4.
Hasta ahora, la toma de decisiones en estos casos se ha basado únicamente en la evolución clínica del paciente. Sin embargo, crece de manera gradual y consistente la bibliografía que evidencia que las mediciones de niveles de fármaco y de anticuerpos antifármaco son clínicamente relevantes para la individualización del tratamiento5.
Desde hace 2 años se encuentra comercializado en nuestro país un enzimoinmunoanálisis (ELISA) para la cuantificación de la concentración sérica libre de ADA, así como de anticuerpos anti-ADA (Promonitor®, Proteomika S.L., distribuido por Menarini Diagnósticos S.A.®), con criterios de precisión, linealidad y validación clínica adecuados para la monitorización terapéutica de ADA6,7. Recientemente, el fabricante ha lanzado una nueva versión con cambios significativos en cuanto a practicabilidad analítica del ensayo.
El objetivo del presente trabajo es describir los resultados obtenidos del estudio comparativo entre las 2 versiones del ELISA comercializado para la monitorización terapéutica de ADA en pacientes con artritis reumatoide (AR).
Material y métodosSe han seleccionado 140 muestras de suero de pacientes con AR tratados con ADA 40mg cada 14 días, con diferentes concentraciones de fármaco y anticuerpos antifármaco, de modo que se cubra todo el rango analítico de la nueva técnica (0,024-12mg/L y 3,5-2.000 UA/mL). De cada paciente se obtuvo una muestra de 5mL de suero antes de la administración subcutánea del fármaco y se conservó congelada a –80°C por duplicado hasta su posterior análisis con las 2 versiones del ELISA, siguiendo las condiciones especificadas por el fabricante.
En la primera versión del ensayo (V1), para la determinación de niveles de ADA la placa se recubrió con TNF-α inmovilizado mediante un anticuerpo monoclonal en una primera incubación. Y para la determinación de anticuerpos anti-ADA, las muestras problema se añadieron a los pocillos previa inmovilización del fármaco. Tras la incubación con la muestra del paciente, en ambos casos la detección se llevó a cabo mediante un anticuerpo monoclonal marcado con biotina y la concentración se determinó por reacción colorimétrica (450nm). Las curvas de calibración se construyeron con 10 diluciones de los estándares (0,156-40ng/mL para ADA y 0,4-100 UA/mL para anticuerpos anti-ADA), y de cada muestra se practicaron 6 diluciones seriadas (1/10-1/10.240), con el fin de garantizar lecturas dentro del tramo lineal de la curva de calibrado.
En la versión actualizada (V2), el rango de calibración es mayor: 1,25-60ng/mL y 3,13-200 UA/mL para la cuantificación de ADA y anticuerpos anti-ADA, respectivamente. Las diluciones por paciente se reducen a 2 (1/10 y 1/200 para ADA, y sin diluir y 1/10 para anticuerpos anti-ADA) y la enzima de marcado pasa a ser estreptavidina conjugada con peroxidasa.
Se calculó la precisión interensayo con el coeficiente de variación. Se realizó la prueba de la t de Student de muestras apareadas para comparar las concentraciones de ADA entre los 2 análisis realizados con la misma versión del ensayo y mediante el estadístico Kappa se evaluó la concordancia tras la categorización de los resultados. Con el análisis de correlación se analizó la relación entre las mediciones con las 2 versiones del ensayo. Y se calcularon el coeficiente de correlación de concordancia (CCC)8, así como su intervalo de confianza, valorando la diferencia promedio a lo largo de todo el intervalo de magnitudes medido mediante la representación de los gráficos de Bland-Altman9.
ResultadosLa reproducibilidad de la nueva versión del ensayo se determinó procesando 20 muestras en 3 días diferentes no consecutivos empleando 2 lotes de reactivo distintos. Se obtuvo una imprecisión media interensayo del 12,5%, mostrando una reproducibilidad aceptable.
Se valoraron las discrepancias entre repeticiones mediante el análisis de 30 muestras de ADA por duplicado con cada una de las versiones del ensayo. Se observan diferencias significativas entre las 2 mediciones con V1 (p<0,001); sin embargo, con V2 no se observan diferencias estadísticamente significativas (p=0,139). Al categorizar las mediciones por rangos (0-3, 3-7, 7-12 y mayor de 12mg/L), se observa una concordancia baja entre las concentraciones de ADA obtenidas con V1 (Kappa 0,14 [0-0,59]) y una concordancia moderada-alta con V2 (Kappa 0,72 [0,44-0,86]).
Para evaluar cuál de las 2 versiones da unos valores más ajustados a la concentración real del fármaco, se ha comparado la cuantificación de ADA en 26 muestras de suero dopadas con concentraciones conocidas del fármaco entre 0,005 y 2,0mg/L. El porcentaje de recuperación medio con respecto a las concentraciones teóricas fue del 42 y el 85% para V1 y V2, respectivamente, mostrando que V2 es mucho más exacta y refleja más fielmente la cantidad de ADA en la muestra.
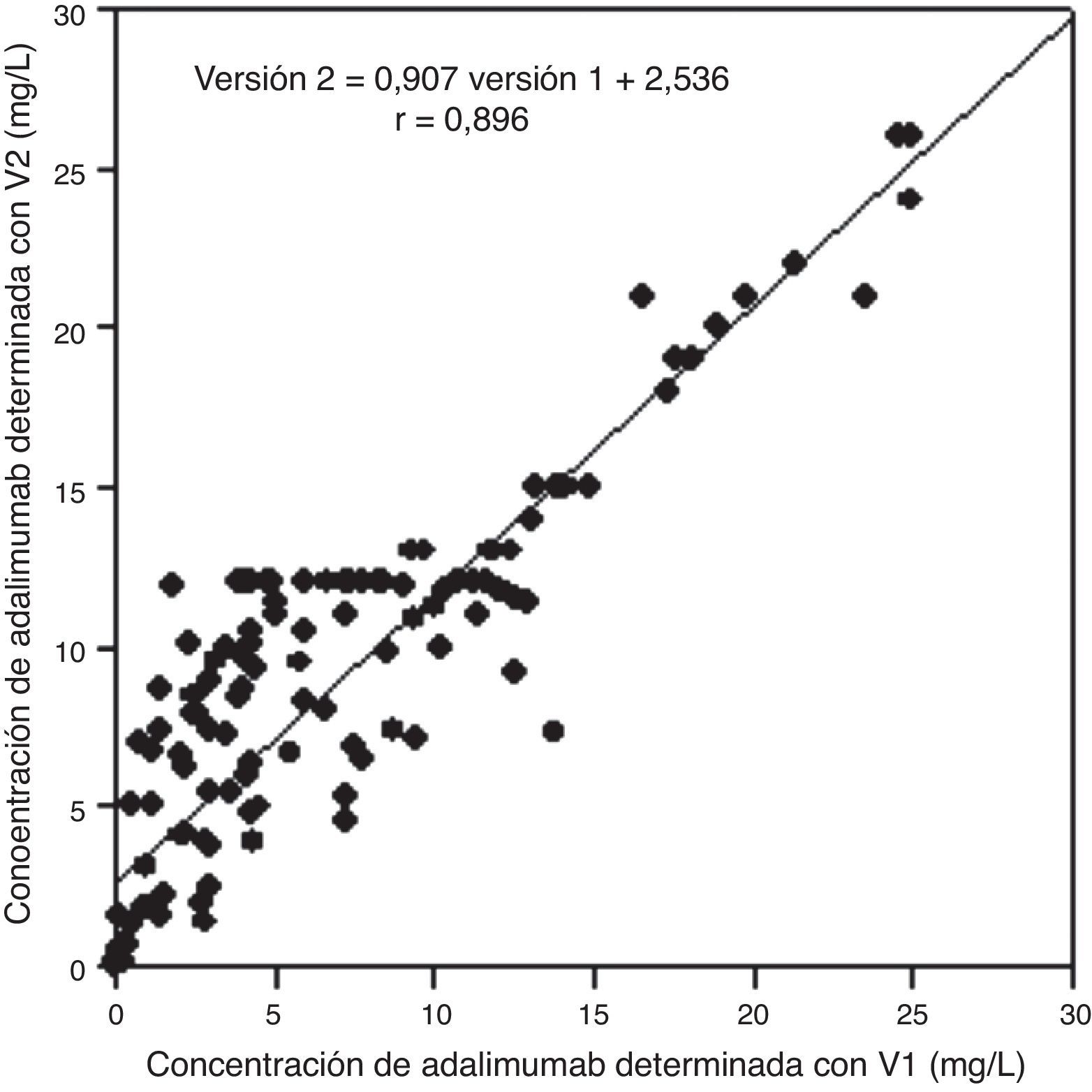
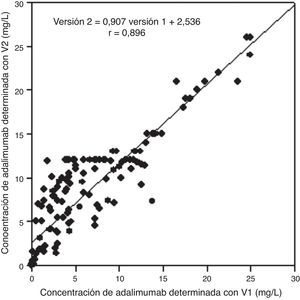
El estudio de comparación entre las 2 versiones del ensayo de ADA (n=140) proporciona un coeficiente de correlación de 0,896 y un CCC de 0,85 (intervalo de confianza del 95%, 0,80-0,89) (fig. 1). El análisis de Bland-Altman muestra un buen acuerdo entre ambos ensayos (bias=−2,0 [2DE: –7,8-3,8]) (fig. 2).
Estudio de comparación mediante análisis de correlación de las concentraciones de adalimumab determinadas con las 2 versiones del ensayo comercializado (n=140). Se ha obtenido un coeficiente de correlación de 0,896 (Versión 2=0,907, Versión 1+2,536) y un coeficiente de correlación de concordancia de 0,85 (IC del 95%: 0,80-0,89).
En el ELISA para la detección de anticuerpos anti-ADA se obtuvo una correlación cuantitativa lineal (r=0,994) entre las mediciones con las 2 versiones del ensayo. La concordancia fue del 100% para las 16 muestras que con V1 dieron positivas a anticuerpos anti-ADA, detectándose además en otras 4 muestras con V2, mostrando una mayor sensibilidad de la versión actualizada.
DiscusiónEl objetivo fundamental de la monitorización del tratamiento farmacológico es mejorar la asistencia y terapéutica del paciente a través del ajuste de la dosis de fármaco en función de las concentraciones plasmáticas10. La monitorización terapéutica de ADA se plantea como una herramienta esencial para garantizar el uso eficiente de este fármaco, ya que su depuración difiere entre individuos de manera significativa y, de momento, se desconocen otros factores que pueden alterar su eliminación11,12. Combinado con otros datos clínicos, proporciona una información muy útil permitiendo el ajuste de dosis en cada paciente de manera guiada, garantizando un efecto terapéutico óptimo y limitando su toxicidad13,14.
Diversos grupos de investigadores han desarrollado diferentes formatos de ensayo para la monitorización de ADA con sus propias ventajas y desventajas (ELISA, radioinmunoanálisis, ensayos celulares). Pero, de momento, no existe un estudio comparativo amplio entre los diferentes ensayos y en algunos casos se han demostrado discrepancias entre las distintas plataformas, evidenciando la necesidad de estandarización15.
De todas las técnicas disponibles, el ELISA es el más utilizado por su facilidad de aplicación en la práctica clínica. La primera versión del ensayo evaluado en este trabajo constaba de múltiples pasos manuales y cada uno de ellos podía ser fuente de introducción de variabilidad analítica: desde el tapizado de los pocillos de la placa hasta la preparación de calibradores, reactivos y muestras. En la nueva versión se limitan al máximo los parámetros que pueden inducir variabilidad en los resultados: los pocillos se presentan pretapizados, los calibradores y reactivos prediluidos y se restringen las diluciones de muestras a las de lectura óptima.
En el estudio comparativo se obtuvo una buena correlación entre las mediciones de ADA y anticuerpos anti-ADA con las 2 versiones del ensayo. En general, V2 proporciona resultados más altos de concentración de ADA que V1 y presenta una mayor precisión en el rango de concentraciones próximas al nivel de decisión clínica, ajustándose más a la concentración real del fármaco en sangre. Además, en la nueva versión del ELISA el tiempo de ensayo se reduce significativamente de 6 a 2,5h y permite la automatización completa, lo cual simplifica mucho el análisis y reduce significativamente la variabilidad en las repeticiones de las muestras por lo que se trata de un método recomendable para su uso rutinario en el laboratorio clínico. Aun así, hay que tener presente que los resultados del ensayo pueden verse influidos por otros factores difíciles de controlar y que pueden afectar al desarrollo de cualquier ELISA.
Asumiendo las limitaciones inherentes a esta técnica, con la disponibilidad de esta nueva versión comercial se facilita la monitorización terapéutica de ADA aportando datos fiables para la toma de decisiones terapéuticas en pacientes con AR. Es necesario continuar en la estandarización y la validación de los ensayos, llegar a un consenso en la interpretación de las concentraciones de fármaco y de anticuerpos antifármaco, estableciendo la ventana terapéutica para cada indicación, y diseñar algoritmos de tratamiento basados en la evidencia y validarlos en la práctica clínica.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes y que todos los pacientes incluidos en el estudio han recibido información suficiente y han dado su consentimiento informado por escrito para participar en dicho estudio.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
FinanciaciónEl estudio fue apoyado con una beca de investigación, por la Asociación para la Investigación en Reumatología de la Marina Baixa (AIRE-MB).
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses en relación con este trabajo.
Grupo AIRE-MB-HGM: Asociación para la Investigación en Reumatología de la Marina Baixa (AIRE-MB): José Rosas, Esteban Salas, José Miguel Senabre-Gallego, Gregorio Santos-Soler (S. Reumatología, Hospital Marina Baixa), Francisca Llinares-Tello, Juan Molina (S. Laboratorio, Hospital Marina Baixa); Carlos Santos-Ramírez (S. Reumatología, Hospital Marina Alta, Denia), Xavier Barber (CIO-Universidad Miguel Hernández, Elche), Mabel Sánchez-Barrioluengo (INGENIO [SIC-UPV], Universitat Politècnica de València).
Hospital Universitario Gregorio Marañón (HUGM): Inmaculada de la Torre, Lara Valor, Diana Hernández, Luis Carreño (S. Reumatología).
Los nombres de los componentes del Grupo AIRE-MB-HUGM están relacionados en el anexo 1.



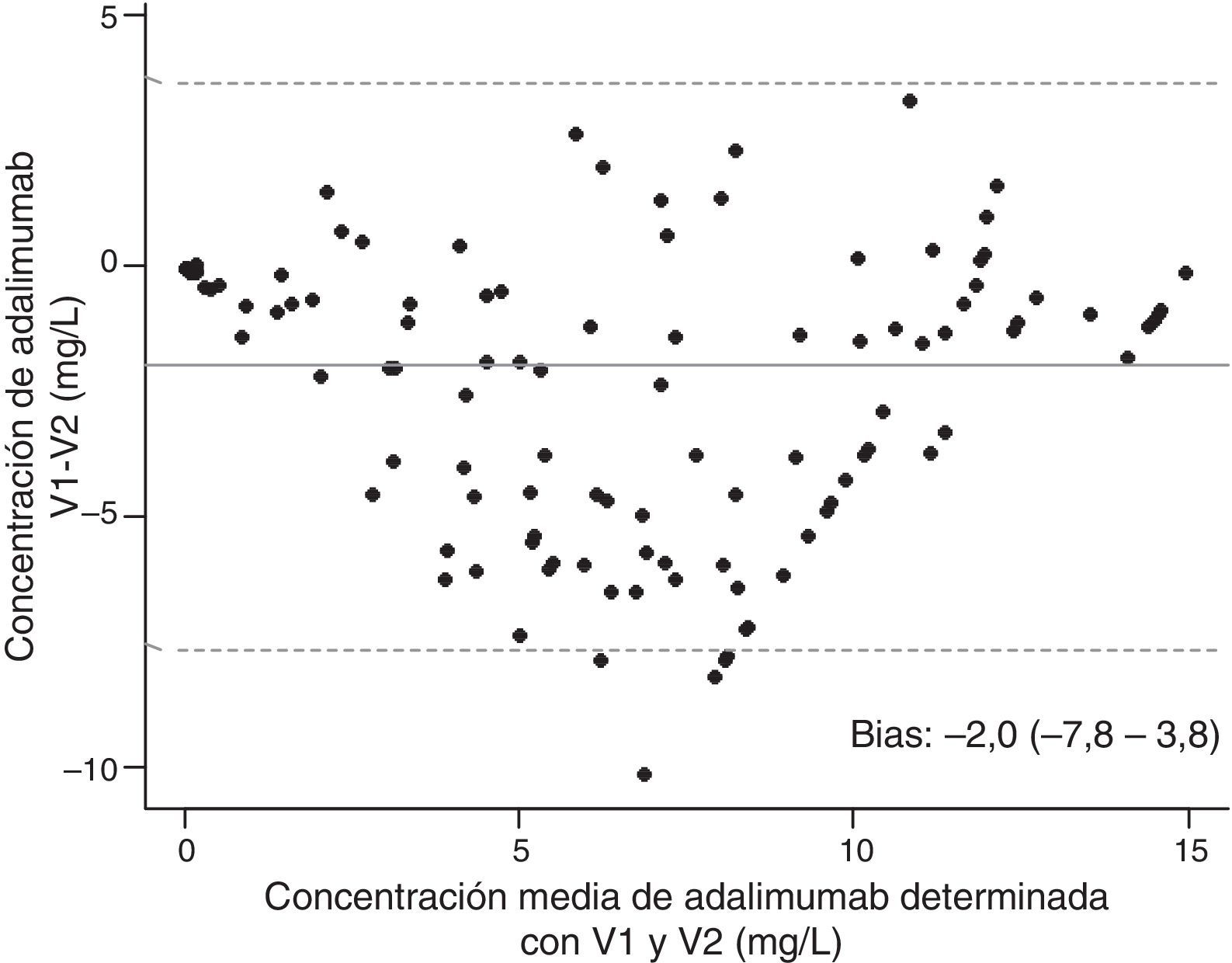
![Análisis de Bland-Altman para las concentraciones de adalimumab determinadas con las 2 versiones del ensayo comercializado. Se valora la diferencia promedio a lo largo de todo el intervalo de magnitudes medido, obteniéndose un buen acuerdo entre ambos ensayos (bias=−2,0 [2DE: –7,8-3,8]). Análisis de Bland-Altman para las concentraciones de adalimumab determinadas con las 2 versiones del ensayo comercializado. Se valora la diferencia promedio a lo largo de todo el intervalo de magnitudes medido, obteniéndose un buen acuerdo entre ambos ensayos (bias=−2,0 [2DE: –7,8-3,8]).](https://static.elsevier.es/multimedia/1699258X/0000001000000002/v2_201404030117/S1699258X13001794/v2_201404030117/es/main.assets/thumbnail/gr2.jpeg?xkr=ue/ImdikoIMrsJoerZ+w937trqSwLGgTrQM2QjUSRyU=)


