La hiperplasia nodular regenerativa hepática (HNRH) es una entidad caracterizada por una transformación benigna difusa del parénquima hepático en pequeños nódulos regenerativos, que puede conducir al desarrollo de hipertensión portal (HP) no cirrótica. Ha sido asociada a varios trastornos, principalmente enfermedades autoinmunes y hematológicas, así como a fármacos inmunosupresores, incluyendo azatioprina y ciclofosfamida1. La HNRH se ha descrito en artritis reumatoide/síndrome de Felty, lupus eritematoso sistémico (LES), síndrome antifosfolipídico (SAF), síndrome de Sjögren, esclerosis sistémica, sarcoidosis, poliarteritis nudosa y crioglobulinemia mixta1-3. Sin embargo, solo se ha publicado un caso en la artritis idopática juvenil (AIJ) de inicio sistémico4.
Un varón de 33 años fue diagnosticado de AIJ de inicio sistémico a los 5 años, basándose en fiebre vespertina, exantema evanescente, artralgias, pericarditis recurrente, reactantes de fase aguda elevados (proteína C reactiva 22,5mg/dl y velocidad de sedimentación globular 39mm/h) y negatividad para factor reumatoide, anticuerpos antinucleares y HLA-B27. Se trató inicialmente con glucocorticoides a dosis bajas y metotrexato, 10mg/semana, pero este último se retiró a los 20 años de edad por neurotoxicidad. Desde entonces, recibía solo glucocorticoides a dosis variables, manteniendo enfermedad activa, leve aumento de alanina-aminotransferasa (ALT) (72 U/l), gamma-glutamiltransferasa (GGT) (171 U/l) y fosfatasa alcalina (FA) (146 U/l), además de trombocitopenia (117×103/μl) con estudio de médula ósea normal. La ultrasonografía y la tomografía computarizada abdominal mostraban esplenomegalia leve, sin signos de HP. Se inició tocilizumab (8mg/kg cada 14 días) en enero del 2011, con rápida mejoría de los síntomas sistémicos y normalización de los reactantes. Sin embargo, tras la tercera infusión presentó empeoramiento de la función hepática, con duplicación de los niveles previos de ALT y GGT, incremento de la aspartato-aminotransferasa (AST) (79 U/l) y la bilirrubina total (BT) (3,51mg/dl), hipofibrinogenemia (122mg/dl), alteración del INR (1.5) y aumento de la trombocitopenia (57×103/μl). Se ingresó con sospecha de síndrome de activación macrofágica. El paciente no había recibido antiinflamatorios no esteroideos u otros fármacos potencialmente hepatotóxicos de forma concomitante. Las serologías para los virus de hepatitis B y C, de Epstein Barr y de inmunodeficiencia humana fueron negativas, y la biopsia de médula ósea mostró cambios reactivos y ausencia de hemofagocitosis. La endoscopia reveló la presencia de varices esofágicas de grado i-ii y la biopsia hepática confirmó el diagnóstico de HNRH (fig. 1-A y B). Se suspendió el tocilizumab definitivamente, con normalización de AST, BT, fibrinógeno e INR, pero los niveles de ALT, GGT, FA y la trombocitopenia permanecieron sin cambios. En controles sucesivos de pruebas de imagen, se observó un aumento del diámetro de la vena porta (17mm) (fig. 1-C), sin evidencia de trombosis. Actualmente, el paciente recibe solo glucocorticoides a dosis variables, con actividad leve-moderada de la AIJ y sin haber desarrollado otras complicaciones de la HP.
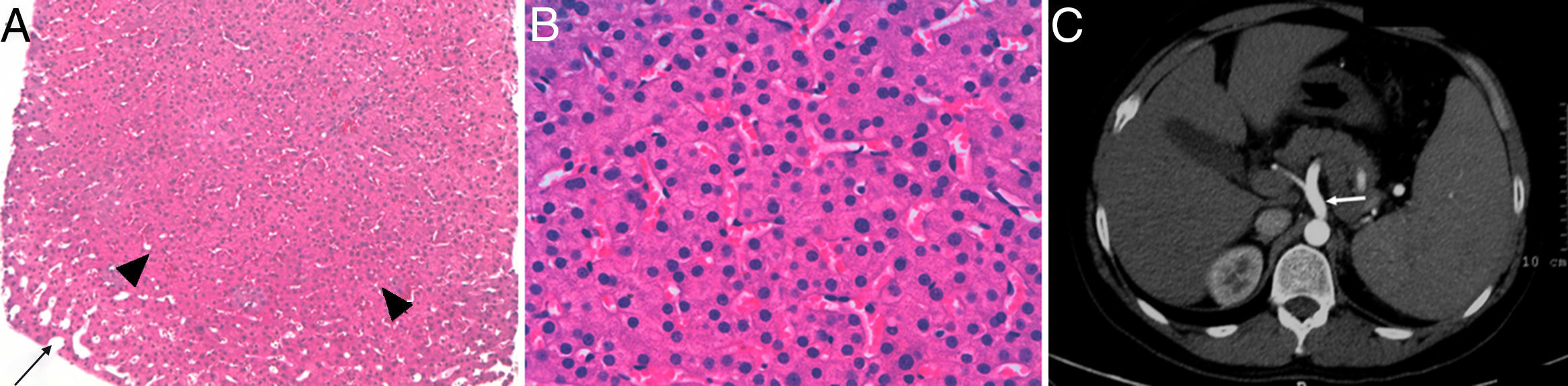
Biopsia hepática en la que se observa una zona nodular hiperplásica (cabezas de flecha) rodeada parcialmente por sinusoides dilatados (flecha) y ausencia de fibrosis (hematoxilina-eosina 2×) (A). A mayor aumento, los sinusoides se encuentran comprimidos por las placas hepatocitarias engrosadas (hematoxilina-eosina 40×) (B). En la tomografía computarizada abdominal, se evidencia la dilatación de la vena porta y sus ramas (flecha) (C).
La patogenia de la HNRH es desconocida, pero se considera como una respuesta adaptativa tisular inespecífica frente a la alteración de la distribución del flujo vascular hepático de causa multifactorial5. Dentro de los factores identificados que pueden originar esta alteración se encuentran la trombosis (trombofilias, neoplasias, trastornos mieloproliferativos, SAF) y la lesión de las células endoteliales de las vénulas portales y sinusoides hepáticos (fármacos, enfermedades autoinmunes, virus)1. En el presente caso, podrían haber estado implicados la enfermedad de base y el tratamiento farmacológico. El estado inflamatorio crónico secundario al largo tiempo de evolución de la AIJ de inicio sistémico se asocia a altos niveles circulantes de citocinas proinflamatorias como la interleucina 6 (IL-6), la cual ha sido implicada en el desarrollo de la HNRH6. Esta citocina es importante en la proliferación de los hepatocitos y la regeneración hepática7. Sin embargo, ratones transgénicos que expresan niveles altos de IL-6 y su receptor soluble (sIL-6R) presentan nódulos hepatocelulares hiperplásicos alrededor de los espacios porta, al igual que la HNRH en humanos6. Existe además evidencia clínica de que el aumento de IL-6 se asocia a HNRH en la enfermedad de Castleman8. Otros trastornos relacionados con la HNRH, como el LES y las neoplasias hematológicas, presentan niveles elevados de complejos IL-6/sIL-6R6. A pesar de que los pacientes con AIJ de inicio sistémico tienen aumento de estos complejos9, la HNRH ha sido descrita raramente en esta enfermedad, habiéndose publicado solo el caso de un paciente de 17 años con hepatomegalia e HP que permitieron detectarla4, pero esto probablemente sea debido al infradiagnóstico de esta entidad1. Los fármacos también se relacionan con el desarrollo de HNRH, principalmente las tiopurinas (azatioprina, 6-mercaptopurina, 6-tioguanina), ciclofosfamida, busulfán, oxaliplatino y fármacos antirretrovirales1. Nuestro paciente no recibió ninguno de estos agentes pero fue tratado durante 15 años con metotrexato, un fármaco que ha sido asociado con hepatotoxicidad y fibrosis hepática pero no con HNRH, encontrándose en la literatura solo el caso de un paciente con enfermedad de Still del adulto tratado de forma simultánea con azatioprina y glucocorticoides, atribuyéndose su desarrollo a la combinación de estos 2 últimos fármacos10, y otro paciente con síndrome de Felty al cual se le diagnosticó la HNRH tras recibir metotrexato por un periodo corto, por lo que los autores concluyeron que no había asociación11. El presente caso recibió además glucocorticoides a dosis variables durante 28 años. Se ha sugerido la asociación de estos fármacos con la HNRH10, desconociéndose los mecanismos implicados. Sin embargo, la corticoterapia crónica se relaciona con el desarrollo de lesiones vasculares en enfermedades autoinmunes, por lo que podría contribuir a la aparición de alteraciones del flujo vascular hepático que conducen al desarrollo de HNRH.
Se debe plantear la posibilidad de HNRH en pacientes con clínica de HP (esplenomegalia, ascitis, várices esofágicas), que presentan transaminasas normales y ausencia de manifestaciones de cirrosis. Se estima que la HNRH representa el 27% del total casos de HP no cirrótica en Europa, pero su diagnóstico presenta un importante retraso debido a que solo el 50% presenta HP y en un 11-25% se encuentra únicamente elevación leve de enzimas hepáticas, generalmente de FA1. Nuestro caso probablemente desarrolló la HNRH de forma insidiosa durante la evolución prolongada de la AIJ de inicio sistémico y fue finalmente la aparición de hepatotoxicidad durante la administración de tocilizumab lo que llevó al diagnóstico, cuando ya había datos de HP. Las pruebas de imagen presentan pobre sensibilidad y especificidad para la detección de la HNRH, por lo que el diagnóstico definitivo requiere la confirmación histológica1. El tratamiento de la HNRH se centra en corregir la causa desencadenante (enfermedad autoinmune, trastorno hematológico, fármacos) y, cuando se ha desarrollado la HP, se deben prevenir y tratar sus complicaciones, siendo el sangrado de várices esofágicas la principal causa de mortalidad en estos pacientes1. En conclusión, la HNRH es una complicación que puede aparecer durante la evolución de las enfermedades autoinmunes, incluyendo la AIJ de inicio sistémico, por lo que debería considerarse en los casos que presentan alteración persistente del perfil hepático, aún sin otros datos de HP.