Determinar las concentraciones de sCD40L en pacientes con SAFP, y su asociación con el número de trombosis.
Pacientes y métodosSe incluyó a pacientes con SAFP y controles sanos de la misma edad y sexo. Para su análisis, los pacientes con SAFP se dividieron en 2 grupos: a) pacientes con 1 trombosis, y b) pacientes > 1 trombosis. Se determinaron las concentraciones de sCD40L por método de ELISA en cada uno de ellos.
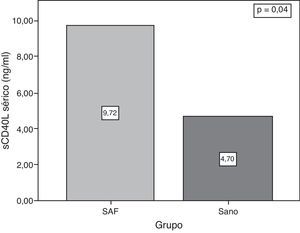
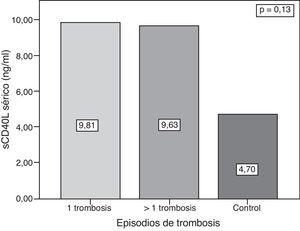
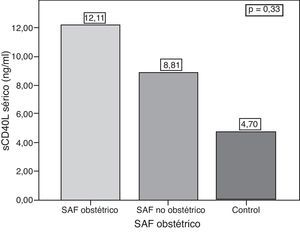
ResultadosLas concentraciones de sCD40L fueron significativamente mayores en los pacientes con SAFP en comparación con el grupo control: 9,72 ± 11,23 ng/ml vs. 4,69 ± 40,04 ng/ml (p = 0,04). No hubo asociación entre las concentraciones séricas de sCD40L y el número de trombosis (9,81 ± 9,67 ng/ml en pacientes con una trombosis vs. 9,6 ± 12,75 ng/ml en ≥ 1 trombosis) (p = 0,13) En mujeres con embarazo y aborto del primer trimestre (13 pacientes), las concentraciones de sCD40L fueron mayores que en aquellas pacientes sin antecedente de aborto (26 pacientes), pero sin una diferencia estadística significativa (12,11 ± 16,46 ng/ml vs. 8,80 ± 8,61 ng/ml; p = 0,33). No se encontró correlación entre las concentraciones de sCD40L y el número total de trombosis.
ConclusionesLos pacientes con SAFP tienen concentraciones mayores de sCD40L en comparación con sujetos sanos, sin que esto se asocie a un mayor número de trombosis. Entre las pacientes con SAFP, existe una tendencia a mayores concentraciones de sCD40L en aquellas con embarazo e historia de aborto. Al ser la plaqueta la principal fuente celular de sCD40L, es posible que esta vía desempeñe un papel patogénico en la enfermedad.
To determine the concentrations of sCD40L in patients with PAPS, and establish its association with the number of thrombosis.
Patients and methodsWe included patients with PAPS and healthy controls of the same age and sex. For analysis, patients with PAPS were divided into 2 groups: 1) patients with 1 thrombosis, and 2) patients with >1 thrombosis. Soluble CD40L concentrations were determined by ELISA method.
ResultssCD40L concentrations were significantly higher in patients with PAPS compared with the controls (9.72 ng ± 11.23 ng/ml vs. 4.69 ± 4.04 ng/ml) (P=.04) There was no association between serum levels of sCD40L and the number of thrombosis (1 thrombosis: 9.81 ± 9.87 ng/ml vs 9.63 ± 12.75 ng/ml in ≥ 1thrombosis (P=.13). In women with pregnancy and abortions, (13 patients) concentrations of sCD40L were higher than in those patients without a history of abortion (26 patients) but without statically significant difference (12.11 ± 16.46 ng/ml vs. 8.80 ± 8.61 ng/ml) (P=.33). There was no correlation between levels of sCD40L and the total number of thrombosis.
ConclusionsPatients with PAPS have higher concentrations of sCD40L compared with healthy subjects, although this is not associated with a greater number of thrombosis. Among patients with PAPS, there is a tendency to higher concentrations of sCD40L in women with pregnancy and history of abortion. Since the platelet is the main cellular source of sCD40L, is possible that this pathway plays a pathogenic role in patients with PAPS.
El síndrome antifosfolipídico primario (SAFP), inicialmente descrito en 1986 por Hughes, Harris y Gharavi1, es una enfermedad autoinmunitaria en la cual se producen anticuerpos contra una variedad de fosfolípidos y proteínas de unión a fosfolípidos. La característica cardinal de este síndrome la constituyen las complicaciones trombóticas. Múltiples mecanismos han sido propuestos para explicar la participación de los anticuerpos antifosfolipídicos en la patogénesis de la entidad, entre ellos: inducción de la expresión de factor tisular por las células endoteliales, inhibición de proteínas anticoagulantes, activación del complemento, así como incremento en la activación plaquetaria2-5.
La activación plaquetaria a través de la vía CD40/CD40L ha sido descrita como un actor fundamental en fenómenos inflamatorios, entre ellos la ateroesclerosis. La aterosclerosis es considerada hoy en día una condición inflamatoria asociada con el SAFP6-8. El CD40 es una glucoproteína de membrana que pertenece a la familia de receptores del factor de necrosis tumoral y se expresa en numerosos tipos celulares, incluyendo las plaquetas, las células endoteliales y los macrófagos9,10. Tras la activación celular desencadenada por la interacción CD40-CD40L, se libera una fracción soluble del ligando a la circulación (sCD40L). Las plaquetas son, con diferencia, las mayores productoras de dicha forma soluble del ligando CD4010.
La interacción CD40/CD40L produce cambios inflamatorios fundamentales en la progresión de la placa aterosclerótica, tales como expresión de moléculas de adhesión celular sobre células endoteliales y incremento de respuesta Th1 sobre sitios de aterosclerosis, así como la producción de citocinas inflamatorias, tales como interleucina-1 e interferón gamma INF-γ11-14. La evidencia clínica actual demuestra una fuerte asociación entre la presencia de fenómenos trombóticos y el incremento en las concentraciones de sCD40L15,16. La incidencia de eventos vasculares cerebrales y coronarios, así como la tasa de reestenosis en pacientes sometidos a angioplastia, se incrementan de forma directamente proporcional a las concentraciones de sCD40L17.
El papel de la activación plaquetaria vía CD40/CD40L en SAF aun se desconoce. Algunos estudios han encontrado incremento en las concentraciones de sCD40L en pacientes con SAF secundario18. Pocos trabajos han sido realizado en pacientes con SAFP y sus resultados no son concluyentes18,19. El objetivo del presente estudio fue determinar las concentraciones séricas medias de sCD40L en pacientes con SAFP y su asociación con el número de fenómenos trombóticos.
Pacientes y métodosSe realizó un estudio transversal y descriptivo en un centro médico de tercer nivel de atención. Se incluyó a pacientes con SAFP con diagnóstico establecido de acuerdo con los criterios revisados del 200620, con edad igual o mayor de 18 años, y con al menos un episodio de trombosis documentado. Se excluyó a pacientes con antecedente de cardiopatía coronaria o con trombosis no relacionada con el SAF, y pacientes diabéticos, con antecedente de cirugía mayor o fenómeno trombótico documentado en los 3 meses previos a la realización del estudio. Se incluyó a 22 controles sanos con características demográficas similares al resto de los pacientes.
Para su análisis los sujetos fueron divididos en 3 grupos: el primero (grupo control) estuvo formado por personal de salud sano del mismo centro hospitalario con características demográficas similares al resto de los grupos de estudio. El segundo grupo se integró con pacientes con SAFP y una trombosis documentada hasta el momento de su inclusión en el estudio; el grupo 3 se conformó con pacientes con SAFP y con 2 o más trombosis documentadas al momento de la inclusión. En los pacientes con SAFP, se recolectó información sobre fecha de inicio de la enfermedad, el número de complicaciones trombóticas, los eventos arteriales o venosos, los títulos de anticuerpos antifosfolipídicos al inicio de la enfermedad y al momento del estudio y la presencia de manifestaciones no trombóticas concomitantes, así como comorbilidades. Todos los pacientes firmaron una carta de consentimiento informado y el estudio fue aprobado por el comité local de ética e investigación en salud.
Métodos de laboratorioDe cada paciente se obtuvo una muestra de 5ml de sangre en tubo seco. Se centrifugó la muestra para separar el suero de los componentes celulares. Se determinaron las concentraciones séricas de sCD40L con el método de ELISA; se utilizó un kit comercial y se siguieron las especificaciones del proveedor (Invitrogen # KHS4001) y para su lectura se empleó un equipo Biotek_ELx. La concentración de sCD40L se expresó en ng/ml.
Análisis estadísticoSe realizaron un análisis estadístico descriptivo para las variables demográficas y una comparación de medias de las concentraciones séricas de sCD40L en los diferentes grupos de estudio mediante ANOVA. Por otra parte, los pacientes fueron agrupados en quintiles según las concentraciones séricas de sCD40 y, posteriormente, se realizó nuevamente prueba de ANOVA de una vía para comparar la media de los episodios de trombosis entre cada uno de los grupos.
ResultadosEntre abril del 2009 y enero del 2010, un total de 47 pacientes con SAFP y 22 controles sanos fueron incluidos. De los pacientes con SAFP, 23 sujetos presentaron un fenómeno de trombosis, en tanto que 24 pacientes presentaron 2 o más complicaciones trombóticas (en promedio 3,2 trombosis por paciente). Las características demográficas de los 3 grupos fueron similares (tabla 1). En el caso de las pacientes embarazadas, el porcentaje de pérdidas fetales fue similar en los grupos con SAFP (30,4% vs. 20,8%) (tabla 1).
Características demográficas de los pacientes
| Variable | SAFP < 1 trombosis | SAFP > 1 trombosis | Grupo control | p |
| (n = 23) | (n = 24) | (n = 22) | ||
| Sexo femenino (%) | 19 (82) | 20 (83) | 17 (77) | 0,85 |
| Sexo masculino (%) | 4 (18) | 4 (17) | 5 (23) | 0,85 |
| Edad (media) | 41,83 | 40,83 | 40,05 | 0,87 |
| Índice de masa corporal | 27,75 | 27,17 | 27,45 | 0,65 |
| Abortos | 0,78 | 0,37 | – | 0,19 |
| Títulos de AcL IgG al momento del diagnóstico | 50,25 | 34,38 | – | 0,43 |
| Títulos de AcL IgM al momento del diagnóstico | 44,5 | 15,17 | – | 0,82 |
| Títulos de AcL IgG al momento del estudio | 47,28 | 45,95 | – | 0,94 |
| Títulos de AcL IgM al momento del estudio | 29,44 | 17,54 | – | 0,38 |
| Manifestaciones no trombóticas (%) | 17 (73,9) | 13 (54,1) | – | 0,15 |
En los pacientes con SAFP, las manifestaciones no trombóticas se presentaron con una frecuencia del 73,9% en aquellos con una sola trombosis vs. el 54,1% de pacientes con 2 o más trombosis (tabla 1). En estos pacientes, la valvulopatía fue la manifestación no trombótica que se observó con mayor frecuencia, siendo las insuficiencias valvulares de diverso grado las más prevalentes. Otras manifestaciones no trombóticas incluyeron la nefropatía por SAF, livedo reticularis y úlceras cutáneas, así como trombocitopenia. La mayor parte de los pacientes presentaron más de una manifestación no trombótica (tabla 2).
Las concentraciones séricas de sCD40L plaquetario fueron mayores en los pacientes con SAFP en comparación con los controles (9,72 ± 11,23 vs. 4,69 ± 4,04; p = 0,04) (fig. 1). Sin embargo, no hubo diferencia entre los grupos con SAFP (9,81 ng/ml en pacientes con < 1 trombosis vs. 9,63 en pacientes con > 1 trombosis; p = 0,13) (fig. 2).
Para evaluar la correlación entre las concentraciones séricas de sCD40L y el número de trombosis en pacientes con SAFP, las concentraciones séricas del sCD40L se distribuyeron en percentiles y se comparó la cantidad de complicaciones trombóticas en cada uno de ellos. Sin embargo, no se logró establecer una asociación entre las concentraciones de sCD40L y el número de trombosis.
De las pacientes con SAFP, 13 tuvieron antecedente de uno o más abortos en el primer trimestre de la gestación (media de 2,1 por paciente).
Al comparar el sCD40L entre el grupo de mujeres con complicaciones en el embarazo y el resto de las mujeres, se observó una tendencia a presentar mayores concentraciones de sCD40L en aquellas con complicaciones obstétricas; sin embargo, no se logró establecer una diferencia significativa (12,1 ± 16,46 ng/ml vs. 8,81 ± 8,61 ng/ml; p = 0,33) (fig. 3).
DiscusiónEn el presente estudio documentamos que los pacientes con SAFP tienen mayores concentraciones de sCD40L en comparación con controles sanos. Sin embargo, no se logró establecer una asociación con número o tipo de trombosis, ni con manifestaciones no trombóticas de la enfermedad.
Múltiples mecanismos han sido evocados para explicar el desarrollo de complicaciones trombóticas en pacientes con SAF, y la activación plaquetaria constituye uno de ellos. Como ya se ha mencionado, la vía del CD40/CD40L ha sido descrita recientemente como un mecanismo patogénico en el fenómeno de aterosclerosis y su influencia en los eventos vasculares coronarios y cerebrales está más que comprobada15-17.
Nuestro trabajo se fundamentó en la determinación de la sCD40L, cuya producción se lleva a cabo en su mayor parte a nivel plaquetario, y en determinar si las concentraciones de este ligando se asociaron a un mayor número de trombosis. Estudios previos han encontrado concentraciones incrementadas de sCD40L en pacientes con SAF secundario en comparación con SAFP o controles sanos18. Nuestro estudio se orientó a pacientes con SAFP, puesto que se conoce el riesgo cardiovascular «per se» que conlleva la coexistencia de otra enfermedad como lupus eritematoso sistémico. Además, es el primer estudio que busca establecer una correlación entre las concentraciones de sCD40L y el número de trombosis en estos pacientes. De manera general, nuestro estudio demostró que las concentraciones del sCD40L son significativamente mayores en sujetos con SAFP vs. controles sanos, pero no se estableció asociación con la cantidad de fenómenos trombóticos. Las razones de esta conclusión pueden ser varias: en primer lugar, cuando en un paciente se establece el diagnóstico de SAFP, se le inicia tratamiento anticoagulante de inmediato. Buena parte de nuestros pacientes son diagnosticados después del primer episodio de trombosis, de tal manera que desde el momento del diagnóstico se encuentra en tratamiento anticoagulante, lo que contribuye a la no recurrencia de complicaciones trombóticas. Por otro lado, es bien conocido que en el SAF los mecanismos patogénicos son numerosos y frecuentemente coexisten, por lo que es posible que mecanismos distintos de la activación plaquetaria vía CD40/CD40L son los que predominan y los que favorecen directamente la trombosis. Finalmente, es probable que las concentraciones de sCD40L se encuentren incrementadas en este grupo de pacientes por la aterosclerosis acelerada que frecuentemente se observa en ellos. De hecho, una alta prevalencia de síndrome metabólico ha sido reportada en nuestra población de pacientes con SAFP19. Se han descrito numerosos mecanismos para explicar la elevada frecuencia de aterosclerosis acelerada en los pacientes con SAF, entre los que destacan: aumento del estrés oxidativo20, presencia de autoanticuerpos dirigidos contra partículas LDL oxidadas21, aumento de la captación de LDL dentro de macrófagos inducida por anticuerpos anti β2GP22, etc. Es posible que en estos pacientes la activación plaquetaria a través de la vía CD40/CD40L sea un mecanismo adicional que contribuya a la aterosclerosis acelerada, y si bien es cierto que su activación no explica la presencia de trombosis de una manera directa, es posible que sí lo haga de manera indirecta a través de mecanismos que favorecen la progresión de lesiones ateroscleróticas, como son activación endotelial y incremento en la expresión de moléculas de adhesión celular, así como de citocinas inflamatorias y trombogénicas. Al respecto, Gresele et al.23 encontraron mayores concentraciones de sCD40L en pacientes con SAFP y factores asociados de riesgo cardiovascular en comparación con pacientes sin ellos.
Un hallazgo que se debe destacar fue la presencia de mayores concentraciones de sCD40L en aquellas pacientes con SAFP y abortos en comparación con pacientes sin morbilidad obstétrica. Es probable que no se alcanzara la significación estadística debido al reducido número de pacientes. Este hallazgo es interesante debido a que la trombosis placentaria no es un hallazgo constante en mujeres con SAF y morbilidad obstétrica. Para explicar las pérdidas gestacionales también se han descrito otros mecanismos, como la activación de la vía clásica del complemento o la resistencia a proteínas como anexina24. Nuestros resultados sugieren que la activación plaquetaria y, específicamente, aquella desencadenada por la activación de la vía CD40/CD40L pudiera tener algún papel patogénico en abortos inducidos por SAF.
Nuestra investigación tiene algunas limitaciones. En primer lugar, el número reducido de pacientes incluidos, lo cual puede explicar que varios de nuestros resultados no alcanzaran una diferencia estadísticamente significativa. En segundo lugar, al ser un estudio transversal, se realizó la medición del sCD40L al momento de ingreso al estudio. Por lo tanto, es posible que la asociación entre las concentraciones del ligando y la presencia trombosis se encuentre subestimada, dado que la temporalidad entre el primer y el último fenómeno trombótico es altamente variable en nuestros pacientes. Esto justifica la realización de un estudio prospectivo con determinación longitudinal del sCD40L de acuerdo con el tiempo de presentación de las complicaciones trombóticas. Por otra parte, solo fue incluido un número pequeño de mujeres con pérdidas fetales, lo que hace difícil establecer conclusiones sobre el impacto de las concentraciones de sCD40L en este subgrupo de pacientes. Finalmente, cabe destacar la elevada frecuencia de manifestaciones no trombóticas que se encuentran en nuestra cohorte de pacientes con SAFP. El SAF microangiopático es una entidad de descripción reciente y que se refiere a la presencia de manifestaciones no relacionadas con trombosis de grandes vasos. En este tipo de manifestaciones, la microangiopatía, la microtrombosis y la disfunción endotelial son el común denominador25. Dado su reciente descripción, los mecanismos patogénicos no han sido completamente caracterizados. Sin embargo, el tamaño de la muestra no nos permite establecer, por el momento, alguna conclusión al respecto, pero cabría cuestionarse si la activación plaquetaria, sea por esta vía, o por otra conocida, desempeña un papel importante en este tipo de manifestaciones.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.