Las crioglobulinas son inmunoglobulinas que precipitan con el frío. Su presencia puede asociarse a un tipo de vasculitis denominada crioglobulinemia. Estas, especialmente las mixtas, se asocian a infecciones como el virus de la hepatitis C hasta en el 60-90% de los casos, aunque también se ha descrito su asociación a enfermedades del tejido conectivo, en las que suele tener un curso más agresivo. Se presenta el caso de una paciente con poliartritis seronegativa que desarrolló isquemia arterial aguda en el contexto de una crioglobulinemia y que ha respondido al tratamiento con rituximab.
Cryoglobulins are immunoglobulins that precipitate at cold temperatures. Their presence can be related to a type of vasculitis referred to as cryoglobulinemia. This condition, especially mixed cryoglobulinemia, has been associated with viral infections like hepatitis C virus in 60%-90% of cases, but it has also been reported in relation to connective tissue diseases, usually resulting in a more severe course. We describe the case of a patient with seronegative polyarthritis who developed acute arterial ischemia in association with cryoglobulinemia, with a good response to rituximab therapy.
La poliartritis es un motivo frecuente de consulta y supone un reto para los reumatólogos por el amplio diagnóstico diferencial que supone. En la práctica clínica, la aparición de nuevos síntomas y datos analíticos durante el seguimiento de un paciente puede conllevar un cambio en el diagnóstico y, por lo tanto, del tratamiento que se inició.
La crioglobulinemia es una vasculitis que se caracteriza por la afectación de vasos de pequeño y mediano calibre. Se han descrito 3 tipos de crioglobulinemia, siendo los tipos ii y iii los que se asocian a enfermedades del tejido conectivo. Las manifestaciones clínicas de la crioglobulinemia pueden variar desde síntomas inespecíficos hasta afectación renal, neuropática, articular o cutánea. Esto hace que en ocasiones estos síntomas se puedan confundir o solapar con los que se presentan en las enfermedades del tejido conectivo, con las que podemos encontrar asociación1.
Se presenta el caso de una paciente cuyo síntoma inicial fue una poliartritis y que durante el seguimiento es diagnosticada de una crioglobulinemia asociada a lupus eritematoso sistémico (LES), con buena respuesta a tratamiento inmunosupresor con rituximab.
Observación clínicaMujer de 41 años, natural de Paraguay, fumadora de 40 cigarrillos/día, sin otros antecedentes de interés, que acude a consulta por poliartritis en manos, pies y tobillos de 2 meses de evolución. Se inicia tratamiento con antiinflamatorios no esteroideos y prednisona, y se solicita un estudio completo de poliartritis. En la analítica presenta proteína C reactiva (PCR) 24,5mg/dl y velocidad de sedimentación globular (VSG) 34mm/h, factor reumatoide y anticuerpos antipéptido cítrico citrulinado negativos, anticuerpos antinucleares (ANA) 1/80 patrón moteado con anticuerpos extraíbles del núcleo (ENAS) negativos. Las hormonas tiroideas, la función hepática y la renal fueron normales. Mantoux, Booster, serología de hepatitis B y C, y de VIH fueron negativos. Las radiografías de manos, pies y tórax fueron normales. A pesar del tratamiento, persistía la artritis de manos, carpos, pies y tobillos. Con el diagnóstico de poliartritis seronegativa, se inicia tratamiento con metotrexato (MTX) 10mg/semana e hidroxicloroquina (HCQ), con respuesta parcial, por lo que se suspende esta última y se asocia leflunomida, con buen control de la enfermedad durante más de un año.
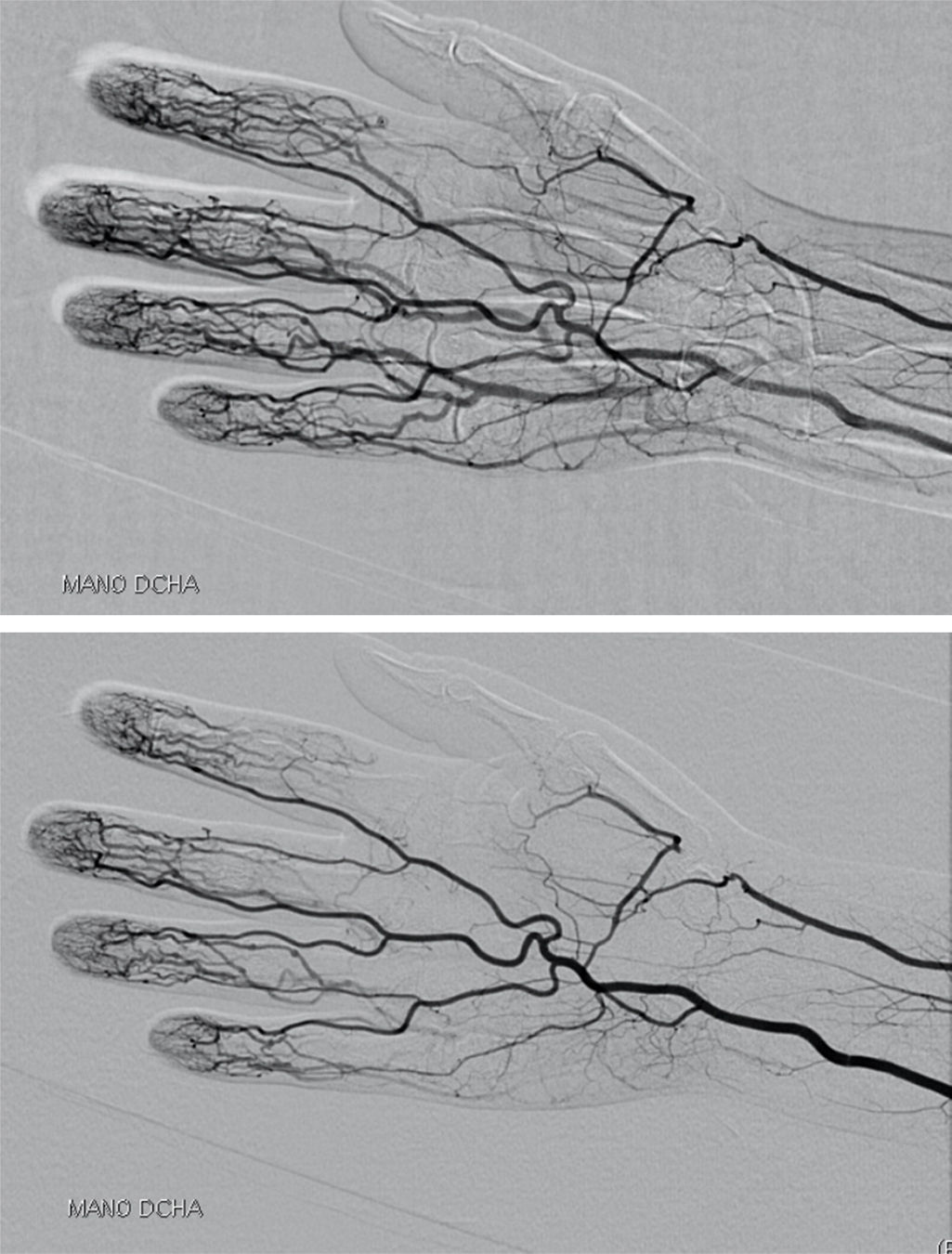
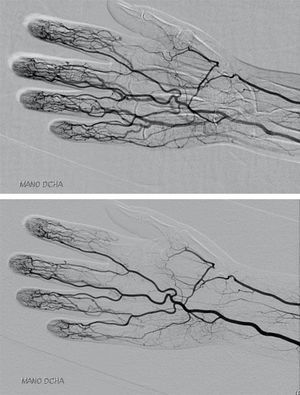
La paciente deja de acudir a nuestras consultas. En octubre del 2012 comienza de forma brusca con cianosis y frialdad en la falange distal del primer dedo de la mano derecha, por lo que se procede a su ingreso hospitalario. Se realiza una angiografía por tomografía computarizada (angio-TAC), en la que se objetiva oclusión de la arteria radial derecha a nivel de la tabaquera anatómica; el resto del estudio (incluidos troncos supraaórticos, estudio arterial de miembros superiores, miembros inferiores y aortografía abdominal) fue normal y no se evidenciaron signos vasculíticos (fig. 1). El electrocardiograma y el ecocardiograma fueron normales. Analíticamente destacaba anemia ferropénica (hemoglobina 8,3mg/dl, hematocrito 27%, hierro 12μg/dl, transferrina 339mg/dl, ferritina 4ng/ml), leucocitos 4.250/μl, linfocitos 510/μl (12%), neutrófilos 3.620/μl (85%) y plaquetas 359.000/mm3. El estudio de coagulación fue normal (actividad de protrombina 118% [70-120] y tiempo de tromboplastina parcial activado 29,7 segundos [23-36]). Los anticuerpos anticardiolipina IgG e IgM y el anticoagulante lúpico fueron negativos. PCR y VSG normales; perfil tiroideo normal. Coombs directo negativo y haptoglobina normal 159mg/dl (30-200); ANA+con anti-ADN+ENAS y anticuerpos anticitoplasma de neutrófilo negativos, las fracciones del complemento C3 y C4 normales, y el proteinograma, normal. Durante el ingreso se inicia tratamiento con heparina de bajo peso molecular, ácido acetilsalicílico (AAS) y alprostadilo por vía intravenosa. Se aumenta la dosis de corticoides y se continúa con MTX y leflunomida (que la paciente seguía tomando a pesar de no acudir a revisiones). Es dada de alta y queda pendiente el resultado de crioglobulinas.
En las sucesivas revisiones en consulta, la paciente presenta buena evolución de la isquemia pero persiste la poliartritis. Las crioglobulinas fueron positivas. Ante la persistencia de la poliartritis a pesar del MTX y leflunomida, y de la crioglobulinemia, se decide iniciar rituximab. Se mantuvo la anticoagulación con acenocumarol durante un año, hasta que las crioglobulinas fueron negativas, iniciándose antiagregación con AAS. Durante su seguimiento la paciente ha presentado repetidamente ANA+a título bajo, con patrón homogéneo y anti-ADN negativos. Se amplió el estudio inmunológico obteniéndose anticuerpos antinucleosoma y anticuerpos contra la región similar del colágeno de C1q+ La paciente ha continuado tratamiento con rituximab, MTX, HCQ y AAS. No ha presentado nuevos episodios isquémicos, ni datos de afectación renal o de otro órgano.
DiscusiónSe presenta el caso de una paciente con poliartritis, motivo frecuente de consulta reumatológica y un reto diagnóstico para el reumatólogo por el amplio diagnóstico diferencial que supone. Inicialmente, ante los datos clínicos y los hallazgos de las pruebas complementarias realizadas, se diagnosticó a la paciente de artritis reumatoide, según los criterios de clasificación de American College of Rheumatology y European League Against Rheumatism (ACR/EULAR)2 del 2010. Por ello se inició tratamiento con fármacos modificadores de la enfermedad (FAME) y corticoides, con buena evolución clínica durante más de un año. Sin embargo, la aparición de nuevos síntomas y datos analíticos durante el seguimiento del paciente nos obliga a replantearnos el diagnóstico inicial o incluso a cambiarlo, como sucede en el caso que se presenta. Finalmente, la paciente reúne criterios para el diagnóstico de LES dado que presenta ANA positivo, anti-ADN positivo, artritis, linfopenia (según los criterios Systemic Lupus International Collaborating Clinics en 20123) y crioglobulinemia mixta.
En esta paciente encontramos anticuerpos antinucleosoma y anti-C1q. Los anticuerpos antinucleosoma podrían ser un marcador serológico muy preciso para el diagnóstico de LES4,5, con una especificidad similar y una sensibilidad levemente superior a los anti-dsADN pero con una odds ratio diagnóstica muy superior (41 vs. 27,8)5. Los nucleosomas median en la unión de los autoanticuerpos con las membranas basales. Estos anticuerpos son capaces de unirse a diversos componentes de la membrana basal glomerular como el colágeno, las proteínas de superficie de membrana, complejos ADN-histonas y cromatina6 produciendo daño renal. Por ello son considerados nefritogénicos y también se han asociado a actividad de la enfermedad cuantificada mediante distintos cuestionarios (SLEDAI, ECLAM…). La activación de la vía clásica del complemento se inicia con la molécula C1q, fundamental en el aclaramiento de inmunocomplejos y restos celulares apoptóticos. El déficit hereditario de C1q se asocia a alta susceptibilidad para el desarrollo de LES, sobre todo con sus manifestaciones mucocutáneas7. Su nivel suele descender durante los brotes de la enfermedad y se asocian a la presencia de anticuerpos frente a C1q (anticuerpos contra la región similar del colágeno), especialmente en pacientes con nefritis lúpica activa8. La presencia de anti-ADN y anti-C1q conlleva la formación de inmunocomplejos, con el posterior desencadenamiento de la respuesta inmunitaria, lo que se suele asociar a mayor riesgo de afectación renal9,10, aunque la expresión de estos anticuerpos y sus niveles no siempre se correlacionan con la actividad de la enfermedad y, por tanto, todavía no se conoce por completo su papel patogénico11. A pesar de ello, la paciente no ha presentado afectación renal a lo largo de los 5 años de seguimiento, posiblemente por haber seguido tratamiento con FAME y finalmente con anticuerpos monoclonales anti-CD20. De igual modo, el uso de corticoides y terapia inmunosupresora ha podido contribuir a que haya mantenido los anticuerpos anti-ADN negativos a lo largo de la evolución.
Además se objetivó la presencia de crioglobulinas, coincidiendo temporalmente con los datos de autoinmunidad descritos anteriormente. Las crioglobulinas son inmunoglobulinas (Ig) monoclonales y/o policlonales que precipitan de manera reversible cuando el suero se incuba a una temperatura inferior a 37°C12. Su presencia en sangre puede producir un proceso vasculítico sistémico de vasos de pequeño y mediano calibre. Las crioglobulinemias se clasifican en 3 formas según la composición del precipitado:
- –
Crioglobulinemia tipo i: compuesta por un solo tipo de inmunoglobulina monoclonal. Se suele asociar a enfermedades linfoproliferativas y mieloma múltiple.
- –
Crioglobulinemia tipo ii: compuesta por IgG policlonal e IgM monoclonal con actividad de factor reumatoide.
- –
Crioglobulinemia tipo iii: formada por IgG policlonal e IgM policlonal con actividad factor reumatoide.
Las crioglobulinemias tipo ii y iii se conocen como crioglobulinemias mixtas (CM) y se suelen asociar a enfermedades del tejido conectivo (ETC) y procesos linfoproliferativos e infecciones, pero con mayor frecuencia se asocian a la infección por virus de hepatitis C (60-90% de los casos)13.
Habitualmente, las crioglobulinemias se manifiestan como fiebre, mialgias, artralgias (la artritis solo se ha descrito en menos del 10% de los casos), púrpura palpable en miembros inferiores (es la manifestación más característica), afectación neurológica (el 17-60% de los pacientes presentarán neuropatía periférica, que puede llegar a ser el primer signo de CM) o renal (se observa hasta en el 30% de los pacientes y se manifiesta en forma de microhematuria y proteinuria)14. Es excepcional que se presente como una isquemia arterial aguda periférica sin otros datos de vasculitis asociados, como sucedió en esta paciente12. La necrosis digital empeora el pronóstico de la CM, ya que se han asociado a alto riesgo de infecciones, sepsis y muerte15. La angio-TAC no identificó lesiones compatibles con afectación vasculítica ni aterosclerótica y la paciente no tenía ninguno de los síntomas antes mencionados.
Desconocemos el papel patogénico de los anticuerpos antinucleosoma y anti-C1q en el cuadro descrito. Pensamos que son marcadores serológicos del LES.
El diagnóstico final fue de CM secundaria a ETC (LES). Las manifestaciones clínicas habituales son debidas al depósito de inmunocomplejos circulantes en la pared de los vasos de pequeño y mediano calibre, iniciando una respuesta inflamatoria que origina una vasculitis sistémica16. El tratamiento se realiza con glucocorticoides e inmunosupresores. También se ha descrito el uso de plasmaféresis cuando el resto de las terapias han sido ineficaces1. En este caso, dadas las manifestaciones clínicas de la paciente y la asociación de la CM con el LES, se optó por rituximab. El uso de anticuerpos monoclonales anti-CD20ha demostrado eficacia en el tratamiento de las vasculitis sistémicas y, aunque no existen datos suficientes en vasculitis crioglobulinémicas no asociadas a VHC, algunas series de casos apoyan la utilización de rituximab en estos pacientes17.
En conclusión, lo peculiar de este caso reside en la forma de presentación de la CM en el contexto de un LES, como una isquemia arterial aguda (oclusión de arteria radial derecha) en una paciente que inicialmente había sido diagnosticada de poliartritis seronegativa. A pesar de la presencia de anticuerpos nefritogénicos, la paciente no ha sufrido afectación renal, permanece en remisión y continúa en tratamiento con rituximab.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.