Describir las diversas manifestaciones clínicas, de laboratorio e imagenológicas torácicas en 14pacientes con poliangeítis granulomatosa (Wegener) (PAG).
Material y métodosPresentamos los datos clínicos, de laboratorio e imagen de pacientes con diagnóstico de PAG. Se incluyeron pacientes con manifestaciones torácicas sugerentes de PAG evaluados en 3hospitales entre los años 2000 y 2012. A todos los pacientes les realizamos tinciones y cultivos bacteriológicos, para micobacterias y hongos, en expectoración y lavado broncoalveolar; anticuerpos anticitoplasma de neutrófilos (ANCA), anticuerpos antinucleares, factor reumatoide y biopsia de órganos afectados.
ResultadosTrece pacientes tuvieron afección de por lo menos 2órganos. Las manifestaciones torácicas fueron nódulos pulmonares, opacidades en vidrio esmerilado y parches de consolidación; otras anormalidades fueron estenosis de tráquea, hemorragia alveolar difusa, masas pulmonares con neumonía organizada. El 78% tuvo ANCA positivos (la mayoría c-ANCA). A 10pacientes se les realizó biopsia de tejido respiratorio (8 de pulmón, una de tráquea y una nasal). En 4pacientes el diagnóstico se sustentó con la afección de diversos órganos, ANCA positivos, biopsia de riñón o piel y respuesta a tratamiento. A los 6-12meses todos los pacientes mostraron mejoría clínica e imagenológica, y el 54% de 11pacientes en seguimiento presentaron recaída.
ConclusionesEn esta serie de casos presentamos la mayoría de las manifestaciones radiológicas torácicas descritas en pacientes con PAG. Enfatizamos el realizar un abordaje diagnóstico ordenado para descartar otras patologías con prevalencia más alta que se expresan con manifestaciones pulmonares similares. La frecuencia de ANCA positivos fue elevada y la recurrencia de enfermedad, frecuente.
To describe the clinical and laboratory data, with special emphasis on thoracic imaging findings, in 14patients with a definitive diagnosis of granulomatosis with polyangiitis (GPA).
MethodsThe clinical and tomographic data of 14patients with a definitive diagnosis of GPA are presented. Patients with thoracic manifestations suggestive of GPA were evaluated in 3hospitals from 2000 to 2012. All patients had a sputum analysis and bronchoalveolar lavage for bacterial, mycobacterial and fungal stains and cultures; antineutrophil cytoplasmic antibodies, antinuclear-antibodies, rheumatoid factor, and a biopsy of involved organs.
ResultsA total of 13patients had at least two organs involved. The most frequent thoracic findings were pulmonary nodules, ground glass opacities and patches of consolidation; other abnormalities were tracheal stenosis, diffuse alveolar hemorrhage, lung masses with organized pneumonia. More than three-quarters (78%) of patients had positive antineutrophil cytoplasmic antibodies (ANCA). Ten patients had respiratory tissue biopsy (8 open lung, one tracheal, and one nasal). In 4patients the diagnosis was made with the classic organ involvement in GPA, positive ANCA, and renal or skin biopsy, and response to treatment on follow-up. At 6-12months all patients showed clinical and radiological improvement, with 54% showing a recurrence of disease.
DiscussionThe majority of thoracic findings described in GPA are presented in this study. A complete diagnostic approach with invasive diagnostic procedures to rule out other more prevalent respiratory diseases with similar thoracic manifestations must be performed. The positivity of ANCA in this study was high, and the recurrence of the disease was frequent.
La poliangeítis granulomatosa (PAG) es el nombre aceptado recientemente para denominar a la granulomatosis de Wegener1 y se define como una enfermedad sistémica con vasculitis necrosante que afecta vasos de pequeño y mediano calibre (capilares, arteriolas, vénulas, arterias) con inflamación granulomatosa que afecta al tracto respiratorio (superior e inferior), y frecuentemente al riñón con glomerulonefritis con necrosis focal2-5. Tiene una prevalencia de 25 a 160casos por millón de habitantes y una incidencia de 9 a 16casos por millón de habitantes y año6,7. La afección respiratoria suele ser la más prevalente desde el inicio de la enfermedad, se presenta hasta en el 90% de los casos durante la evolución y característicamente está causada por inflamación necrosante granulomatosa y sus complicaciones asociadas y/o por capilaritis2-5. Las manifestaciones radiológicas y tomográficas torácicas más frecuentes son nódulos pulmonares, que en la mayoría de los pacientes son bilaterales y en el 50% se acompañan de cavitación8-13. En la mitad de los pacientes se presentan opacidades de diversos tipos, desde difusas de baja densidad o en vidrio esmerilado, de baja densidad en parches, hasta consolidaciones con bordes mal definidos con o sin cavitación8-13. En el 15 al 30% de los casos hay afección del árbol traqueobronquial. El objetivo del presente trabajo es presentar las manifestaciones clínicas, los hallazgos de laboratorio y las alteraciones imagenológicas diversas en una cohorte de 14pacientes con PAG en la presentación inicial y posterior a tratamiento.
MétodosSe incluyeron pacientes hospitalizados que se presentaron con afección respiratoria en 3centros hospitalarios entre los años 2000-2012 que cumplieron los criterios diagnósticos de Chapell-Hill2 para PAG, en la ciudad de San Luis Potosí (México). San Luis Potosí es un estado con 2.585.518 habitantes y recibe pacientes referidos de otros estados de la República, que incluyen 10circunvecinos. Se recolectaron los datos clínicos, de laboratorio e imagen en forma retrospectiva. Todos los pacientes fueron evaluados en forma conjunta por reumatólogos y neumólogos.
A todos los pacientes se les realizó hemograma, química sanguínea, proteína C reactiva, pruebas de funcionamiento hepático, determinación de anticuerpos anti-citoplasma de neutrófilos (ANCA) por inmunofluorescencia, anticuerpos antinucleares, factor reumatoide y tomografía axial computarizada (TAC) de tórax; a 12pacientes se les determinó depuración de creatinina. A 2pacientes con hemorragia alveolar difusa se les realizó anticuerpos anti-membrana basal glomerular. Todos los pacientes contaron con estudio de muestras de expectoración y lavado broncoalveolar, que incluyeron tinciones de Gram, Ziehl-Nilssen, PAS y Grocott, así como cultivos para bacterias, micobacterias y hongos. En 5 de 10pacientes con nódulos pulmonares diseminados se realizaron hemocultivos y ecocardiograma transtorácico. En 10pacientes se obtuvieron biopsias de tejido respiratorio (8 de pulmón, uno traqueal y uno nasal), en 2 biopsia renal y en 3 de piel.
Once pacientes fueron seguidos por consulta externa después de la hospitalización y se les realizó TAC de tórax en 6-12meses del inicio de tratamiento.
ResultadosOnce pacientes (84%) fueron del género masculino, con edad promedio de 44años. El promedio de evolución de los síntomas fue de 5,3meses. Las manifestaciones clínicas se describen en la tabla 1. En 10 de 12pacientes con determinación de depuración de creatinina la filtración glomerular fue normal (valores de 100 a 120ml/min), uno con 80ml/min y uno con 10ml/min. En todos los pacientes el lavado broncoalveolar resultó negativo para cualquier tipo de germen. En los 2casos con hemorragia alveolar difusa los anticuerpos antinucleares y anti-membrana basal glomerular resultaron negativos y el lavado broncoalveolar fue diagnóstico de hemorragia alveolar.
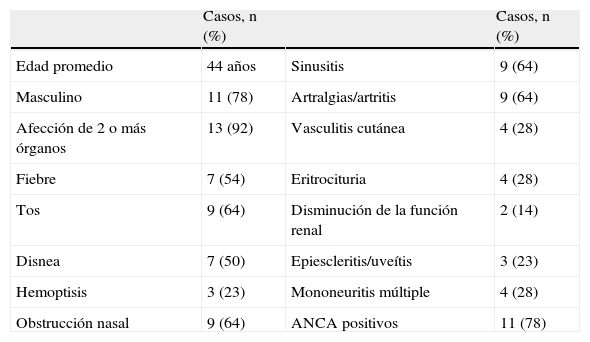
Síntomas y manifestaciones sistémicas en 14 pacientes con poliangeítis granulomatosa
| Casos, n (%) | Casos, n (%) | ||
| Edad promedio | 44 años | Sinusitis | 9 (64) |
| Masculino | 11 (78) | Artralgias/artritis | 9 (64) |
| Afección de 2 o más órganos | 13 (92) | Vasculitis cutánea | 4 (28) |
| Fiebre | 7 (54) | Eritrocituria | 4 (28) |
| Tos | 9 (64) | Disminución de la función renal | 2 (14) |
| Disnea | 7 (50) | Epiescleritis/uveítis | 3 (23) |
| Hemoptisis | 3 (23) | Mononeuritis múltiple | 4 (28) |
| Obstrucción nasal | 9 (64) | ANCA positivos | 11 (78) |
ANCA: anticuerpos anticitoplasma de neutrófilo.
El diagnóstico definitivo fue obtenido por biopsia de tejido respiratorio en 10pacientes (71%): 8 de tejido pulmonar, uno de tráquea y uno nasal; 3 de ellos con ANCA negativos (tabla 2); en todas las biopsias se demostró vasculitis con necrosis y granulomas como hallazgo principal. En los 4 (29%) casos que no se realizó biopsia de tejido respiratorio el diagnóstico se estableció con la conjunción de: datos de afección sistémica, nódulos pulmonares, sinusitis, eritrocituria, función renal alterada, artralgias o artritis, vasculitis cutánea, mononeuritis múltiple, ANCA positivos; además, en 2 de estos casos se realizó biopsia de piel y en los otros 2 biopsia de riñón, que demostraron vasculitis leucocitoclástica sin depósito de anticuerpos y glomerulonefritis con necrosis focal o segmentaria pauci-inmune, respectivamente (tabla 2). Los ANCA resultaron positivos en 11pacientes (78%): 8 con patrón citoplasmático y 3 perinuclear. Solo un paciente de los 3 con ANCA negativos presentó enfermedad limitada al aparato respiratorio con neumonía cavitada y sinusitis.
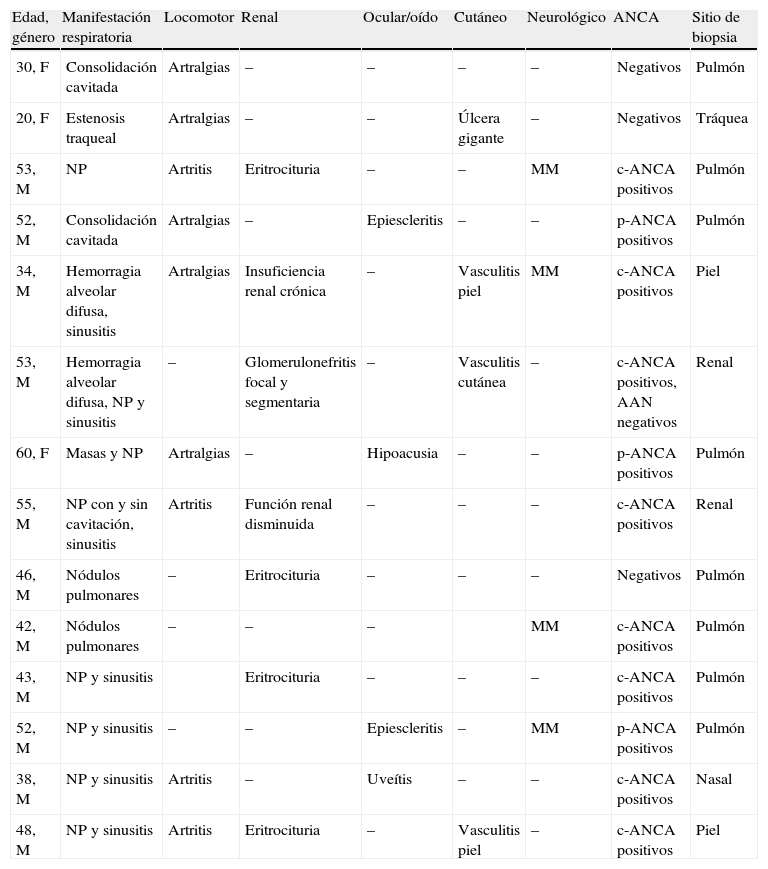
Manifestaciones sistémicas, resultados de ANCA y sitio de biopsia en 14 pacientes con poliangeítis granulomatosa
| Edad, género | Manifestación respiratoria | Locomotor | Renal | Ocular/oído | Cutáneo | Neurológico | ANCA | Sitio de biopsia |
| 30, F | Consolidación cavitada | Artralgias | – | – | – | – | Negativos | Pulmón |
| 20, F | Estenosis traqueal | Artralgias | – | – | Úlcera gigante | – | Negativos | Tráquea |
| 53, M | NP | Artritis | Eritrocituria | – | – | MM | c-ANCA positivos | Pulmón |
| 52, M | Consolidación cavitada | Artralgias | – | Epiescleritis | – | – | p-ANCA positivos | Pulmón |
| 34, M | Hemorragia alveolar difusa, sinusitis | Artralgias | Insuficiencia renal crónica | – | Vasculitis piel | MM | c-ANCA positivos | Piel |
| 53, M | Hemorragia alveolar difusa, NP y sinusitis | – | Glomerulonefritis focal y segmentaria | – | Vasculitis cutánea | – | c-ANCA positivos, AAN negativos | Renal |
| 60, F | Masas y NP | Artralgias | – | Hipoacusia | – | – | p-ANCA positivos | Pulmón |
| 55, M | NP con y sin cavitación, sinusitis | Artritis | Función renal disminuida | – | – | – | c-ANCA positivos | Renal |
| 46, M | Nódulos pulmonares | – | Eritrocituria | – | – | – | Negativos | Pulmón |
| 42, M | Nódulos pulmonares | – | – | – | MM | c-ANCA positivos | Pulmón | |
| 43, M | NP y sinusitis | Eritrocituria | – | – | – | c-ANCA positivos | Pulmón | |
| 52, M | NP y sinusitis | – | – | Epiescleritis | – | MM | p-ANCA positivos | Pulmón |
| 38, M | NP y sinusitis | Artritis | – | Uveítis | – | – | c-ANCA positivos | Nasal |
| 48, M | NP y sinusitis | Artritis | Eritrocituria | – | Vasculitis piel | – | c-ANCA positivos | Piel |
AAN: anticuerpos antinucleares; ANCA: anticuerpos anticitoplasma de neutrófilo; c-ANCA: anticuerpos anticitoplasma de neutrófilo, patrón citoplásmico; F: femenino; M: masculino; MM: mononeuritis múltiple; NP: nódulos pulmonares; p-ANCA: anticuerpos anticitoplasma de neutrófilo, patrón perinuclear.
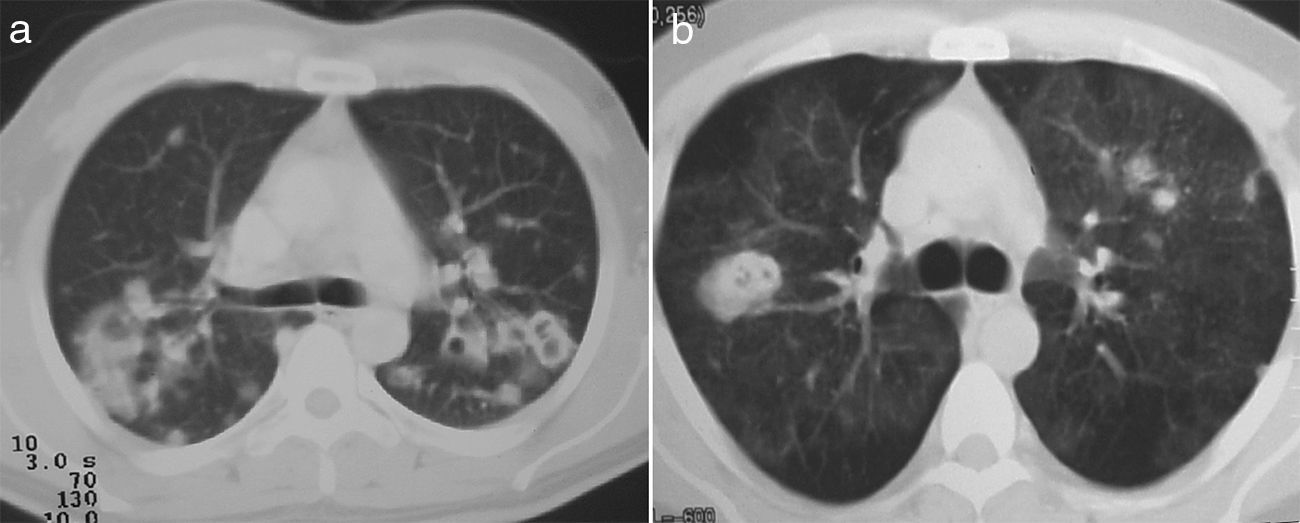
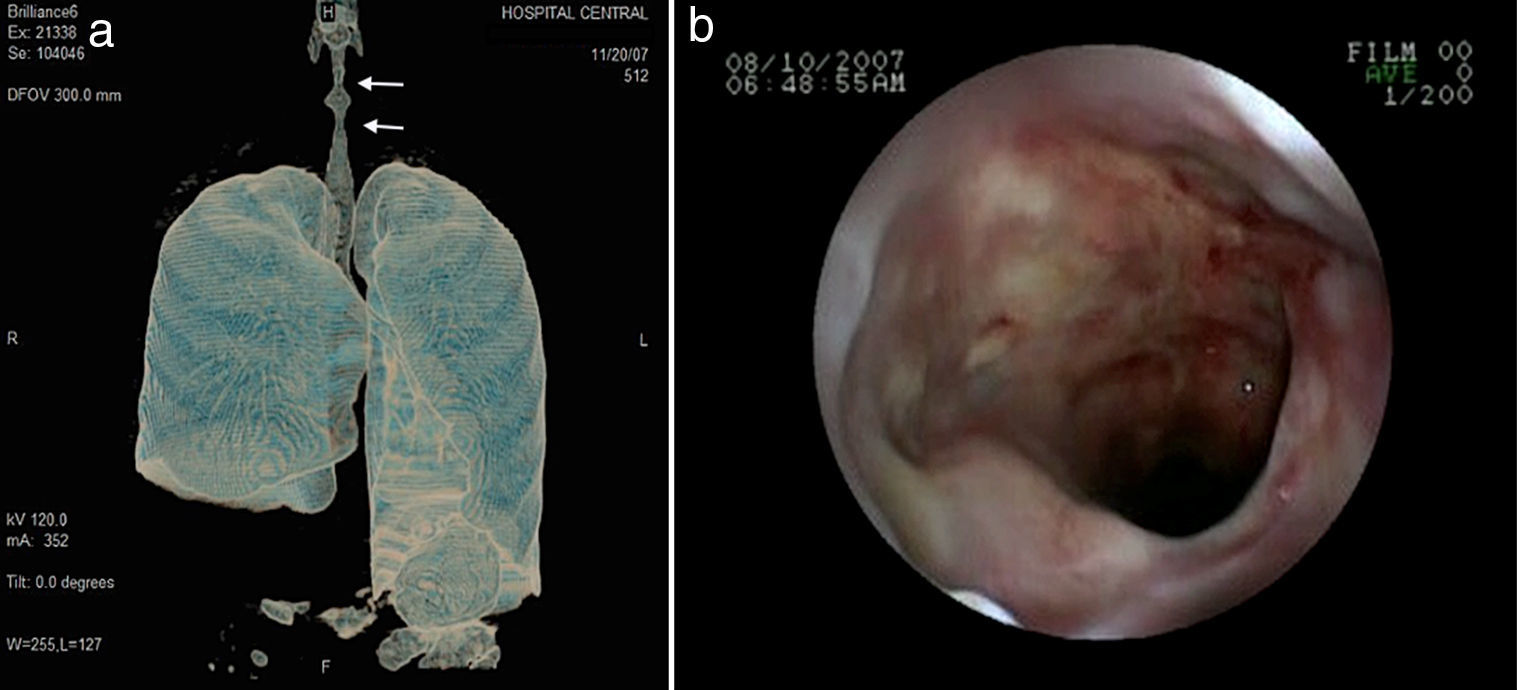
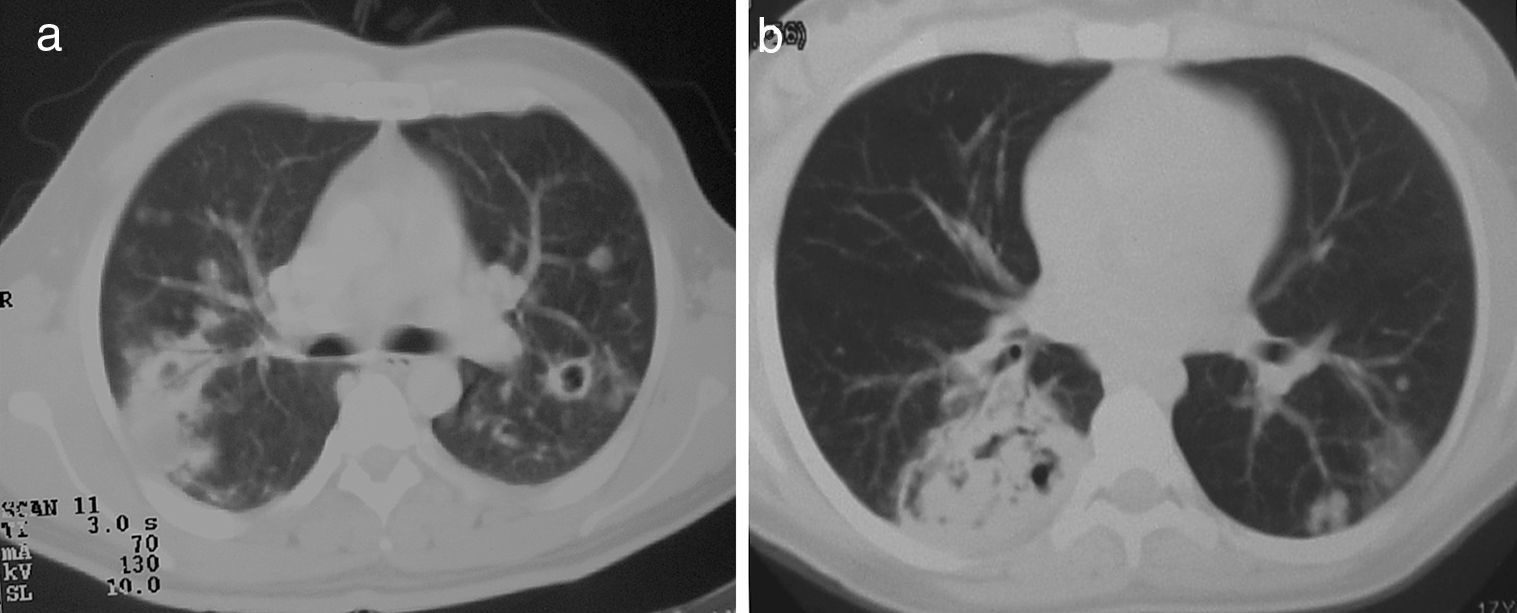
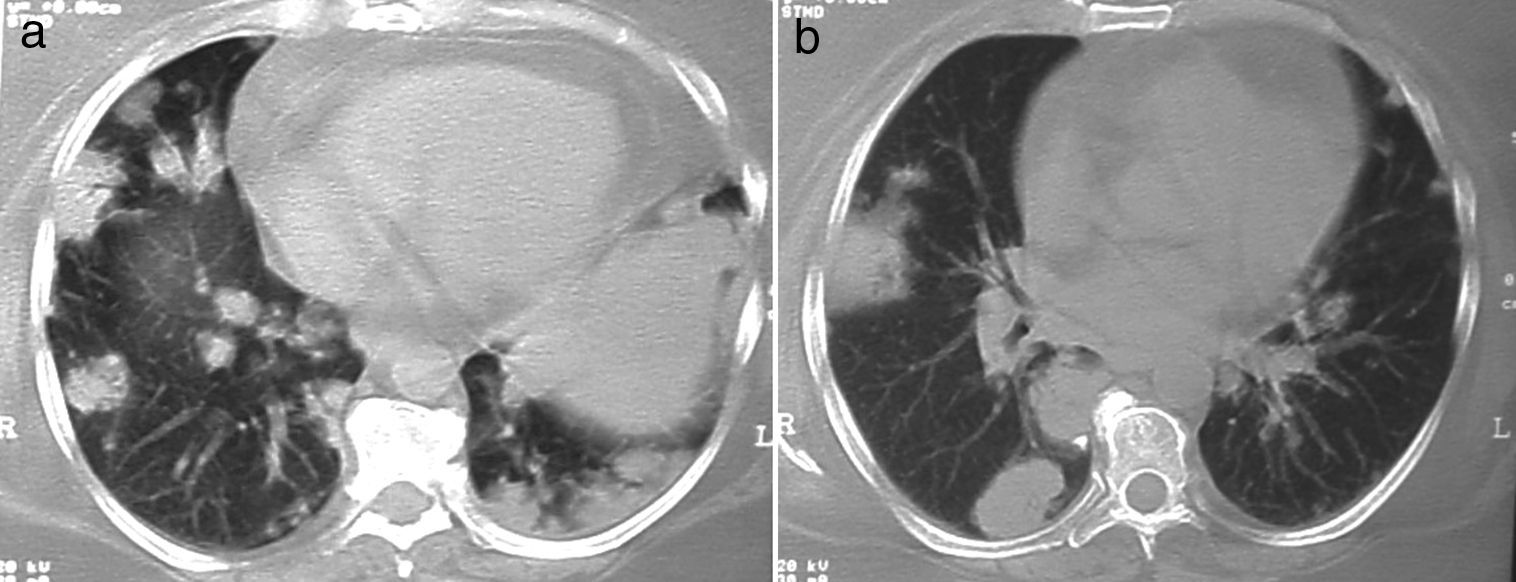
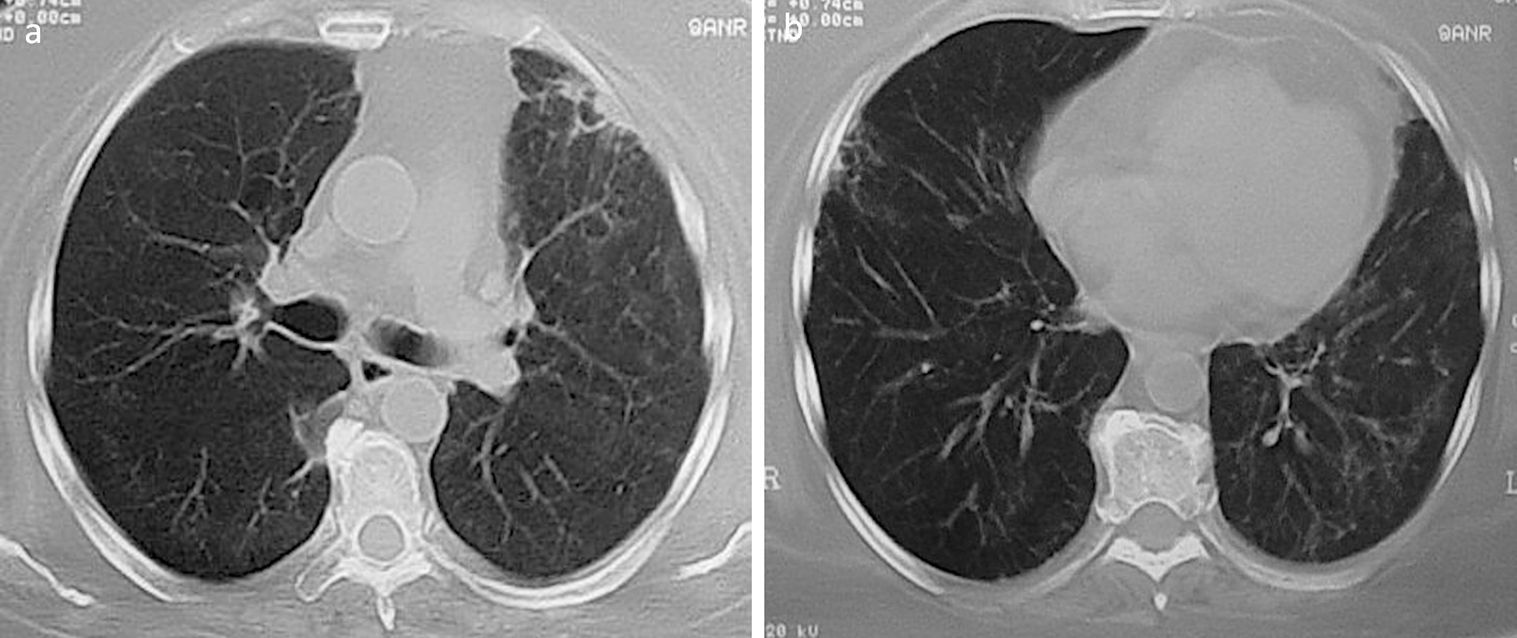
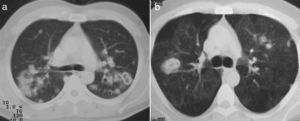
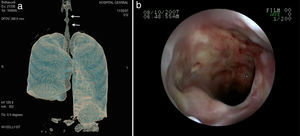
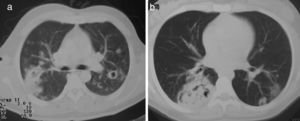
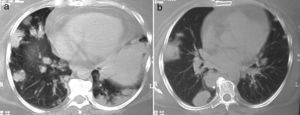
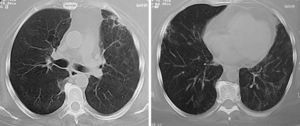
Los nódulos pulmonares (NP) fueron el patrón de afección respiratoria más frecuente, presentes en 9pacientes (64%) (fig. 1a y b). Los NP fueron de bordes bien definidos y se distribuyeron de manera similar en lóbulos superiores e inferiores. El número de nódulos por paciente osciló de 2 a 20, con una media de 12. El diámetro de los nódulos/masas osciló de 10 a 75mm. En un paciente se observó el signo del halo en algunos nódulos. En 5 de los 9pacientes los NP estaban cavitados, con paredes gruesas de bordes internos irregulares, sin nivel líquido en su interior; en 3 casos los NP fueron la única anormalidad pulmonar y en 6 se acompañaron de otras anormalidades, como consolidación pulmonar en 6 (42%) (fig. 2), vidrio esmerilado en parches o generalizado en 3 (21%) (fig. 2), patrón en mosaico en 2 (14%) (fig. 1) y nódulos centrilobulillares en 2 (14%) (fig. 1). Otras manifestaciones torácicas fueron: estenosis subglótica con afección de mucosa traqueal sin otras lesiones respiratorias (fig. 3a y b); neumonía crónica cavitada en segmentos superior y posterior de lóbulo inferior derecho con 2nódulos pulmonares no cavitados adyacentes (fig. 2a y b); ambos casos con ANCA negativos. Un paciente presentó masas pulmonares y NP no cavitados, en la biopsia pulmonar se evidenció neumonía organizada y vasculitis granulomatosa con necrosis (fig. 4a y b). Solo 2pacientes presentaron datos sugerentes de disminución de calibre de bronquios lobares por TAC, con hallazgos broncoscópicos normales y sin evidencia de reducción en el diámetro de la luz de dichos bronquios.
Se encontraron adenopatías mediastinales aisladas en 3pacientes (23%), paratraqueales izquierdas o derechas y subcarinales, con diámetro promedio de 11mm. Tres pacientes presentaron discreto engrosamiento pleural en regiones posteriores en el tercio inferior del tórax. Dos pacientes presentaron llenado alveolar y vidrio esmerilado difusos como expresión de hemorragia alveolar confirmado por lavado broncoalveolar, uno de ellos con NP asociados (fig. 1a) y sin insuficiencia respiratoria aguda hipoxémica; otro con necesidad de ventilación mecánica invasiva e insuficiencia renal rápidamente progresiva.
Siete pacientes recibieron ciclofosfamida, 6ciclos mensuales (1g/dosis i.v.) y mantenimiento con azatioprina (100-150mg/día), debido a afección renal grave al momento del diagnóstico o durante la evolución; el resto de los pacientes recibieron tratamiento con azatioprina y/o metotrexato (17,5mg/semana), los cuales fueron variados durante la evolución debido a respuesta al tratamiento y/o eventos adversos, 3pacientes recibieron terapia conjunta con azatioprina y trimetoprim con sulfametoxazol, y todos recibieron esteroides a diferentes dosis durante la evolución del padecimiento.
SeguimientoSe realizó tomografía de control después de 6-12meses de tratamiento inmunomodulador en 11pacientes, 8 de ellos con nódulos pulmonares; 3pacientes fueron seguidos en otros hospitales, no se contó con los datos clínicos/radiológicos subsecuentes. En 5, hubo desaparición total de los nódulos, en los 3restantes se evidenció disminución ≥90% de los mismos (fig. 5a) En todos los pacientes quedaron opacidades lineales o en banda que retraían pleura o vasos parenquimatosos en algunos sitios donde se encontraban previamente los nódulos (fig. 5b). En ningún caso hubo cavitaciones persistentes. Las áreas que presentaban vidrio esmerilado tuvieron imagen normal en el seguimiento. En el caso de afección traqueal subglótica hubo progresión a estenosis total a pesar de infiltración de la pared traqueal con esteroides y dilatación con balón.
a y b)Mismo paciente de figura 4 tras 4meses de tratamiento con inmunomoduladores. Se observa la desaparición de las masas y de los nódulos; solo persisten bandas fibrosas y parches focales de fibrosis.
Seis pacientes de 11 con seguimiento durante al menos un año presentaron recurrencia de la enfermedad (54%) al disminuir tratamiento, 5 de ellos con nódulos pulmonares y uno con hemorragia alveolar, con patrón radiológico muy similar en 4 de ellos. Un paciente presentó el signo de «cascabel» en el interior de una cavitación periférica en la TAC a los 12meses de seguimiento, sugerente de fungoma, que a la biopsia abierta mostró vasculitis necrosante granulomatosa sin evidencia de hongos o micobacterias; un año más tarde este mismo paciente presentó recurrencia de nódulos múltiples y una cavitación extensa subpleural (diámetro de 6cm) en el lóbulo inferior derecho; la broncoscopia con lavado broncoalveolar y biopsias de la pared de la cavitación mostraron bacilos ácido-alcohol resistentes; presentó mejoría después de adicionar a su tratamiento inmunomodulador y medicamentos anti-tuberculosis14.
DiscusiónSe presenta una cohorte de casos con PAG y afección respiratoria diversa como manifestación clínica inicial. Esta serie, si bien está conformada por un número pequeño de pacientes, compila gran parte de las manifestaciones torácicas características descritas en la literatura asociadas a esta enfermedad3-5,8-13, y la mayor parte de los casos cuentan con diagnóstico histológico definitivo y tienen tomografía de control posterior al tratamiento.
El grado de afección respiratoria y el promedio de meses transcurridos entre el inicio de los síntomas y el diagnóstico señalan la importancia de que el médico internista o el especialista en enfermedades respiratorias se encuentren familiarizados con las manifestaciones respiratorias clínico-imagenológicas de esta enfermedad, tanto para un diagnóstico como para un tratamiento tempranos. Debido a lo inespecífico de los síntomas, de la presentación radiológica y de la diversidad de su expresión clínica, no es raro que se realicen otros diagnósticos que tienen mayor prevalencia.
La frecuencia de NP fue del 64%, la mitad de ellos cavitados, lo que corresponde con lo informado en la literatura (del 65-70 y del 50%, respectivamente)3,8-13. Dado que los NP son la manifestación imagenológica principal en PAG, el diagnóstico diferencial suele hacerse fundamentalmente con procesos infecciosos por micobacterias y hongos, metástasis de neoplasias sólidas, otros procesos granulomatosos y endocarditis bacteriana. En 6 de 9pacientes con nódulos pulmonares hubo presencia de otro tipo de opacidades; la consolidación pulmonar suele representar infartos pulmonares y hemorragia15; la opacidad en vidrio esmerilado puede ser resultado de hemorragia alveolar, infiltración de paredes alveolares con necrosis o un patrón de perfusión alterado por vasculitis de vasos pequeños15; el patrón en mosaico y los nódulos centrilobulillares pueden traducir afección arteriolar16.
No se recomienda que el diagnóstico de PAG se sustente solo en la positividad de ANCA de manera aislada10, sino que estos sean un elemento más en una enfermedad sistémica compatible con PAG. La especificidad de ANCA para PAG depende en gran medida de la probabilidad clínica pre-prueba, y dado que esta enfermedad es poco frecuente en nuestro medio, es recomendable descartar otras enfermedades más prevalentes y comórbidas, como los procesos granulomatosos infecciosos10,17,18.
El resto de anormalidades presentes en los estudios de imagen han sido descritas con frecuencia baja, semejante a la presente cohorte: engrosamiento pleural, adenopatías mediastinales o hiliares, del 5 y 15%, respectivamente8-11. La hemorragia alveolar difusa, frecuentemente causada por vasculitis asociadas a ANCA y presente en el 10% de los casos de PAG, presenta un patrón clínico-radiológico característico de insuficiencia respiratoria aguda hipoxémica, con vidrio esmerilado o consolidación difusa de ambos pulmones, frecuentemente asociada a afección renal19. Es recomendable realizar diagnóstico diferencial con otras entidades que producen este síndrome, tales como lupus eritematoso sistémico, poliangeítis microscópica, enfermedad neumorrenal asociada a anticuerpos anti-membrana basal glomerular, síndrome antifosfolípido y poliangeítis granulomatosa con eosinofilia (síndrome de Churg-Strauss), además de comorbilidades asociadas, como neumonitis urémica e insuficiencia cardíaca. La historia clínica, la broncoscopia con LBA para análisis microbiológico, la biopsia renal (para descartar depósito de anticuerpos y verificar el patrón de afección glomerular), AAN, anti-MBG y ANCA son herramientas útiles para establecer el diagnóstico definitivo10.
Son de interés los casos con manifestaciones torácicas poco frecuentes, como pudo observarse en el paciente con masas pulmonares cuya histología reveló neumonía organizada y vasculitis granulomatosa necrosante adyacente, hecho que ha sido descrito previamente por Oikonomou et al.20, y representa la respuesta inflamatoria diversa del pulmón ante diferentes patologías; la sobreposición de patrones histológicos pueden ser reflejo de la respuesta del hospedero y representan dificultades en la interpretación, aunque habitualmente resultan de ayuda para explicar las alteraciones que se observan a través de los estudios de imagen. La neumonía cavitada con nódulos adyacentes, presentación inusual de la PAG, también representa un reto diagnóstico y terapéutico, pues la asociación de episodios adversos relacionados con el tratamiento que incluyen a las infecciones pudiera semejar la enfermedad14.
Los cambios radiológicos encontrados en el seguimiento de los pacientes han sido descritos en otras series y suelen interpretarse también como característicos5,11-13. En la mayor parte de las ocasiones los nódulos desaparecen sin dejar huella, y en otros dejan lesiones que representan residuos de cicatrización.
Es importante señalar las dificultades diagnósticas que representa el hallazgo de cavitaciones aisladas con paredes internas irregulares, en particular en países de alta prevalencia de tuberculosis, diagnóstico que debe de tenerse presente tanto al inicio de la vasculitis sistémica como tras la administración de tratamiento inmunomodulador21,22. Es recomendable realizar estudios invasivos, ya sea broncoscopia que incluya toma de biopsia o biopsia abierta, para descartar complicaciones infecciosas (hongos y micobacterias) en el contexto de un paciente inmunosuprimido14,21.
El paciente con estenosis subglótica no respondió al manejo médico e intervencionista; la terapia propuesta en estos casos no siempre resulta de utilidad, con un número de casos limitados en la literatura y sin respuesta a terapia sistémica, aunque se han descrito casos aislados que responden a la infiltración con esteroides de la mucosa y dilatación con balón23,24, terapia que resultó ineficaz en nuestro paciente. La afección del árbol traqueobronquial se presenta del 15 al 30% en diversas series8-10; suelen observarse engrosamientos de la pared de diversos bronquios, ya sean principales o lobares, así como reducción del calibre de su luz.
Esta cohorte de PAG es representativa de la expresión pulmonar variable de esta vasculitis sistémica, que habitualmente representa reto diagnóstico y terapéutico tanto para el internista y el neumólogo, cuanto para el reumatólogo. El abordaje requiere del análisis crítico de evidencia clínica, imagenológica, biomarcadores, cultivos y de estudios histológicos a través de broncoscopia o biopsia pulmonar por toracoscopia, al inicio y no rara vez durante el seguimiento bajo la terapia con inmunomoduladores.
Las limitaciones de esta cohorte son el número reducido de casos, lo que pudiera ser reflejo del sistema adecuado de referencia para estos pacientes. Por otro lado, la razón de que todos los pacientes tienen afección clínica respiratoria está relacionada en gran medida con el hecho de que los pacientes incluidos fueron referidos al servicio de enfermedades respiratorias.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes y que todos los pacientes incluidos en el estudio han recibido información suficiente y han dado su consentimiento informado por escrito para participar en dicho estudio.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.