El proyecto AR Excellence evalúa la atención clínica a los pacientes con artritis reumatoide (AR) en España. El objetivo del presente estudio es analizar la utilización de metotrexato (MTX) en AR Excellence y compararla con las recomendaciones vigentes.
Pacientes y métodosSe revisó a pacientes con AR que habían iniciado tratamiento con MTX, recogiendo datos demográficos, dosificación, vías de administración, combinaciones con otros fármacos antirreumáticos modificadores de enfermedad (FAME), tiempo hasta combinación con otro FAME (convencional o biológico) y efectos adversos.
ResultadosSe incluyó a 625 pacientes con AR (edad media de 55,1 años; 70,6% mujeres), con una duración media de la AR de 21,3 meses. El 90% inició tratamiento con MTX. La dosis media de inicio fue de 11mg semanales; en el 58% de los casos se incrementó la dosis. El tiempo medio hasta alcanzar la dosis plena de MTX (20mg semanales) fue de 6,67 meses. El tiempo hasta la combinación de MTX con otro FAME sintético o biológico fue de 3 meses. El 67,4% de los pacientes recibieron el MTX por vía oral y el 18,6%, subcutáneo. En el 12% de los casos se cambió la vía de administración, transcurrida una media de tiempo de 6 meses. En 544 pacientes se asociaron suplementos de folato. El 17,3% de los sujetos presentaron acontecimientos adversos por MTX.
ConclusiónEl MTX es el fármaco sobre el que pivota el tratamiento de la AR. El subanálisis del proyecto AR Excellence nos informa de que la escalada a sus dosis plenas no se realiza con la rapidez adecuada. La vía subcutánea se utiliza en pocos pacientes.
The AR Excellence project evaluates clinical monitoring in patients with rheumatoid arthritis (RA) in Spain. The aim of the study was to analyze the use of methotrexate (MTX) in the AR Excellence cohort and to compare it with current recommendations.
Patients and methodsWe collected data from RA patients who initiated treatment with MTX. They included demographics, dose and routes of administration, switching among them, highest dose in each route, combinations with other disease-modifying antirheumatic drugs (DMARDs), time to combination with another DMARD (either conventional or biological) and adverse events.
ResultsSix hundred twenty-five patients with RA (mean age 55 years; 70.6% women) were included, with an average disease duration of 21 months. Ninety percent of the patients initiated treatment with MTX. Therapy was begun with a mean dose of 11mg per week; this initial dose was increased in 58% of the individuals. The average time to reach the full dose of MTX (20mg a week) was 6,67 months. Time to combination of MTX with another DMARD, either synthetic or biological, was 3 months. In all, 67.4% of the patients received oral MTX and the route was subcutaneous in 18.6%. In 12% of the cases, there was a change in the route of administration after a period of 6 months. In 544 patients, folate supplements were added to MTX; MTX-related adverse events were detected in 17.3% of the patients.
ConclusionMTX is currently the pivotal treatment in RA. The subanalysis of the AR Excellence project demonstrates that MTX escalation to its full doses is not done with adequate speed. The subcutaneous route is used in a small proportion of patients.
A pesar de las múltiples recomendaciones sobre el uso de metotrexato (MTX) en la artritis reumatoide (AR), existe todavía mucha variabilidad en el manejo clínico del mismo. Aspectos como la dosificación, el esquema de escalado y desescalado, la vía de administración, el uso concomitante de ácido fólico y la influencia del fármaco en la combinación con agentes biológicos, entre otros, muestran grandes diferencias en los distintos estudios; además, se dispone de poca información sobre estos en España1-6.
La Sociedad Española de Reumatología (SER) ha llevado a cabo el proyecto AR Excellence, cuyo fin es evaluar la calidad de la atención clínica a los pacientes con AR7. La base de datos AR Excellence contiene abundante información sobre la utilización de MTX en la práctica clínica real. Ello nos permite analizarla y compararla con las recomendaciones vigentes sobre la utilización de este fármaco4,6,8-11. El objetivo de este subestudio fue, pues, evaluar el uso clínico de MTX en los pacientes con AR en España, utilizando la información contenida en AR Excellence.
Pacientes y métodosDiseñoEl proyecto Ar Excellence es un estudio descriptivo, retrospectivo y multicéntrico realizado en los servicios de Reumatología de centros hospitalarios españoles. El objetivo de este proyecto es evaluar la calidad asistencial de los pacientes con AR mediante un indicador compuesto construido a partir de un conjunto de indicadores de calidad consensuados por un grupo de expertos utilizando una técnica Delphi a 2rondas y ponderados a partir de criterios de relevancia clínica y de factibilidad12.
Selección y reclutamiento de centrosSe invitó a participar a todos los servicios de Reumatología de centros españoles (públicos y privados) registrados en la base de datos de la SER, la cual recoge información sobre más del 90% de los centros hospitalarios españoles. El reclutamiento fue consecutivo, cronológicamente, según orden de llegada de la solicitud para participar en el proceso de evaluación. La participación de los centros fue voluntaria. El total de centros participantes fue de 34 distribuidos por toda la geografía española. Se excluyeron aquellos servicios en los que la incidencia de AR fue inferior a 5 casos por 100.000 personas/año. La evaluación de la calidad asistencial en los servicios de Reumatología se realizó entre octubre del 2014 y junio del 2015. Se obtuvo la aprobación del comité de ética y de investigación clínica del Hospital Universitario Puerta de Hierro-Majadahonda, de la comunidad de Madrid.
Recogida de la información y tamaño muestralSe recabó información para la evaluación de los indicadores de calidad a partir de las historias clínicas de los pacientes mayores de 18 años diagnosticados de AR según criterios ACR/EULAR de 201013 entre el 1 de enero del 2010 y el 31 de diciembre del 2013 en una consulta externa de Reumatología. Los pacientes incluidos debían continuar en seguimiento en el Servicio de Reumatología donde se realizó el diagnóstico hasta el 31 de diciembre del 2013. Se excluyeron las historias clínicas de los pacientes con AR que habían participado en ensayos clínicos durante el periodo anteriormente mencionado. De igual manera, se excluyeron aquellas historias clínicas con imposibilidad de recoger información por cualquier causa. El tamaño muestral se estimó para el cumplimiento del indicador compuesto ponderado, asumiendo una distribución binomial. Se seleccionaron 19 historias clínicas por cada Servicio de Reumatología incluido, para garantizar como mínimo un 75% de aciertos asumiendo un fallo (no cumplimiento) y con un error de muestreo de 0,0268.
El muestreo se hizo de forma aleatorizada, con reposición hasta alcanzar el tamaño muestral por centro. Cada hospital facilitó el número total de historias clínicas de pacientes que cumplían con los criterios de selección y, a partir de una aleatorización numérica, se seleccionaron las historias clínicas a revisar. La información fue recogida en un cuaderno de recogida de datos (CRD) por 2profesionales externos cualificados y entrenados. El CRD fue diseñado y consensuado por el investigador principal y el comité científico del proyecto. Posteriormente, esta información fue volcada a una base de datos en formato SPSS para el análisis de los resultados. El CRD fue pilotado en 19 historias clínicas de un centro.
VariablesLas variables recogidas para el presente trabajo fueron las siguientes: pacientes con AR que inician un tratamiento con MTX, dosis de inicio de MTX, pacientes con incremento o reducción de la dosis de MTX, tiempo hasta alcanzar la dosis plena de MTX (20mg/semana), pacientes en los que aparecieron efectos adversos asociados a MTX, pacientes en tratamiento con ácido fólico o folínico asociado a MTX, pacientes con dosis final de MTX inferior a 7,5mg/semana, vía de administración del MTX, cambio de vía de administración del MTX a lo largo del tratamiento, el tiempo hasta el cambio de la vía de administración y el tiempo hasta la combinación con otro FAME (convencional o biológicos).
Análisis estadísticoLas variables numéricas con distribución normal se expresaron con medias y desviación estándar (DE), y las variables numéricas asimétricas con mediana y rango intercuartílico (p25-p75). Se calcularon frecuencias absolutas y relativas para las variables cualitativas. La gestión de los datos y los análisis estadísticos se centralizaron en la Unidad de Investigación de la SER según un plan de análisis prefijado. Todos los análisis se realizan mediante el programa estadístico SPSS 21.0. Se asumió un nivel de significación estadística inferior a 0,05.
ResultadosSe incluyó en el estudio a 625 pacientes con AR de 34 servicios de Reumatología de España, siendo la media de pacientes por centro de 18,1 (DE: 1,3). La edad media fue de 55,1 años (DE: 15,2); 441 pacientes eran mujeres (70,6%) y 184 (29,4%) hombres. La duración media de la enfermedad fue de 21,3 meses (DE: 13,4). Seiscientos catorceindividuos (98,2%) tenían positivo el factor reumatoide sérico y 565 (90,4%) eran portadores de anticuerpos contra péptidos citrulinados (ACPA). El 17,9% de los sujetos eran fumadores activos.
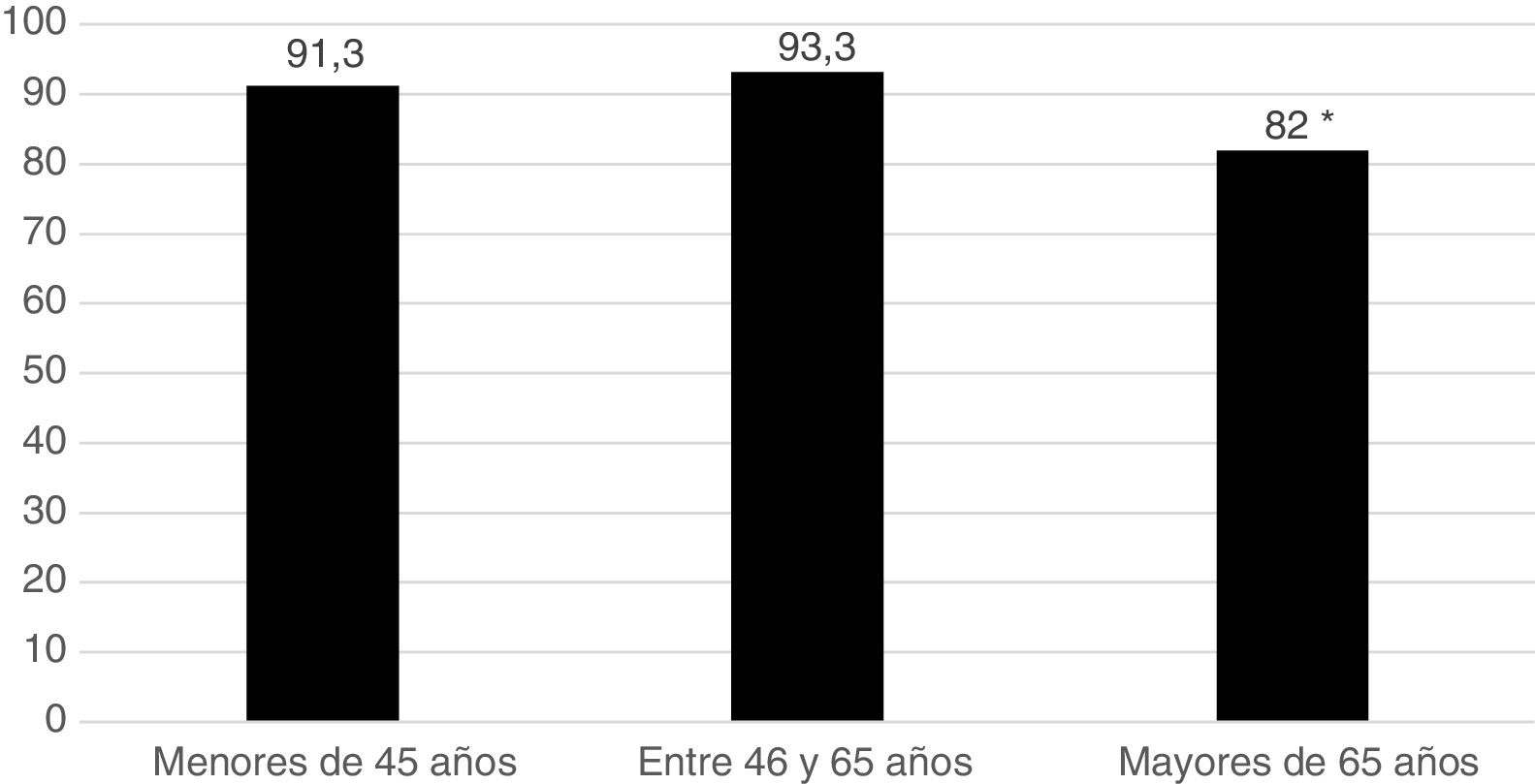
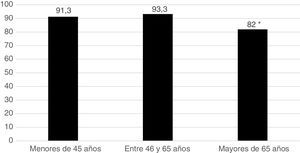
Quinientos sesenta y un pacientes (89,8%) iniciaron el tratamiento con MTX (el 90,7% de las mujeres y el 87,5% de los varones). En la figura 1 se representa el inicio del tratamiento con MTX según los distintos tramos de edad de los pacientes, observándose que el grupo en el que la indicación del fármaco es menor es el de mayores de 65 años. Ningún paciente usó sulfasalazina o antimaláricos en tratamiento combinado. Se utilizaron ambos FAME en monoterapia: 134 pacientes (21,4%) recibieron hidroxicloroquina y 29 pacientes (4,6%), sulfasalazina. Se utilizó estrategia de tratamiento por objetivos T2T. El valor medio pretratamiento con MTX del DAS28 fue de 4,66; el 98,2% de los pacientes fueron factor reumatoide positivo y el 90,4% fueron ACPA positivos.
La dosis media de inicio de la terapia con MTX fue de 11mg semanales (DE: 3,2); en el 58,2% de los sujetos se incrementó esta dosificación inicial y en el 8% de los sujetos se redujo. El tiempo medio hasta alcanzar la dosis plena de MTX (20mg semanales) fue de 6,67 meses (DE: 3,75, mediana = 3,75 [1,83-9,16]) y tan solo 15 individuos (2,7%) presentaban al final del esquema terapéutico con MTX una dosis inferior a 7,5mg semanales. El 5,3% de los pacientes combinaron el MTX con leflunomida y el 3,4% con un FAME biológico. El tiempo hasta la combinación de MTX con otro FAME sintético o biológico fue de 3 meses (intervalo 0-11 meses). El 67,4% de los pacientes recibieron el MTX por vía oral y el 18,6% por vía subcutánea; en el 14% restante no se pudo obtener la vía inicial de administración del fármaco. En el 11,85% de los casos hubo cambio de la vía de administración, transcurrido una media de tiempo de 5,7 meses (intervalo: 2,7-9,6 meses). En el momento de pasar a 15mg, un 33,3% de los pacientes recibían MTX por vía oral, un 38,9% por vía subcutánea y de un 27,7% no conocemos la vía de administración del MTX. La información sobre resultados se amplía en las tablas 1-3. No se obtuvieron datos suficientes para poder relacionar los cambios de dosis o de la vía de administración del MTX con los niveles de actividad de la enfermedad. No se analizaron posibles cambios en la utilización del MTX sobre la base del tipo de hospital o la región del mismo.
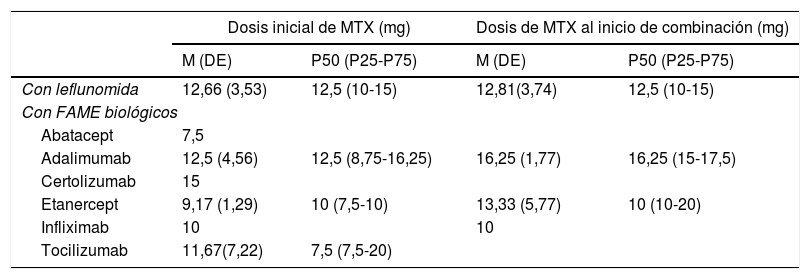
Dosificación del MTX en su combinación con leflunomida y con los distintos FAME biológicos: dosis inicial de MTX en monoterapia y dosis al comenzar la terapia combinada
| Dosis inicial de MTX (mg) | Dosis de MTX al inicio de combinación (mg) | |||
|---|---|---|---|---|
| M (DE) | P50 (P25-P75) | M (DE) | P50 (P25-P75) | |
| Con leflunomida | 12,66 (3,53) | 12,5 (10-15) | 12,81(3,74) | 12,5 (10-15) |
| Con FAME biológicos | ||||
| Abatacept | 7,5 | |||
| Adalimumab | 12,5 (4,56) | 12,5 (8,75-16,25) | 16,25 (1,77) | 16,25 (15-17,5) |
| Certolizumab | 15 | |||
| Etanercept | 9,17 (1,29) | 10 (7,5-10) | 13,33 (5,77) | 10 (10-20) |
| Infliximab | 10 | 10 | ||
| Tocilizumab | 11,67(7,22) | 7,5 (7,5-20) | ||
DE: desviación estándar; FAME: fármacos antirreumáticos modificadores de enfermedad; M: media; MTX: metotrexato.
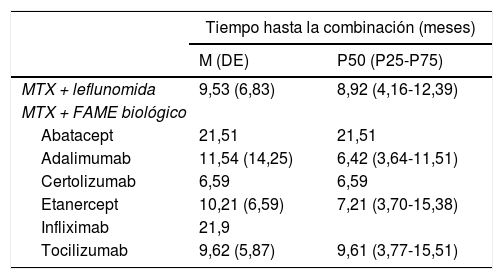
Tiempo transcurrido entre el inicio de la monoterapia con MTX y el comienzo de la terapia combinada MTX + otro FAME
| Tiempo hasta la combinación (meses) | ||
|---|---|---|
| M (DE) | P50 (P25-P75) | |
| MTX + leflunomida | 9,53 (6,83) | 8,92 (4,16-12,39) |
| MTX + FAME biológico | ||
| Abatacept | 21,51 | 21,51 |
| Adalimumab | 11,54 (14,25) | 6,42 (3,64-11,51) |
| Certolizumab | 6,59 | 6,59 |
| Etanercept | 10,21 (6,59) | 7,21 (3,70-15,38) |
| Infliximab | 21,9 | |
| Tocilizumab | 9,62 (5,87) | 9,61 (3,77-15,51) |
DE: desviación estándar; FAME: fármacos antirreumáticos modificadores de enfermedad; M: media; MTX: metotrexato.
Dosificación del MTX cuando se verifican los cambios de vía de administración del fármaco. Tiempo transcurrido hasta la trasferencia entre las vías de administración
| Dosis en el momento del cambio (mg) | ||
|---|---|---|
| M (DE) | P50 (P25-P75) | |
| Oral → subcutánea | 18,87 (4,68) | 20 (15-20) |
| Subcutánea → oral | 13,5 (4,28) | 13,75 (10-15) |
| Tiempo hasta el cambio (meses) | ||
|---|---|---|
| M (DE) | P50 (P25-P75] | |
| Oral → subcutánea | 7,92 (7,57) | 5,70 (2,95-9,51) |
| Subcutánea → oral | 7,71 (6,13) | 6,07 (3,7-12,98) |
DE: desviación estándar; M: media; MTX: metotrexato.
En 544 pacientes (97%) se administraron, asociados al MTX, suplementos de ácido fólico/folínico. Se detectaron acontecimientos adversos atribuidos al MTX en 97 individuos (17,3%). No se dispone de información para especificar el órgano/aparato afectado por la reacción adversa a MTX, ni para cuantificar la intensidad de las mismas. En 97 individuos (17,3%) se interrumpió el MTX por problemas de seguridad farmacológica; las suspensiones del fármaco por falta de eficacia se produjeron en el 9% de los pacientes.
DiscusiónNumerosos documentos de recomendaciones y guías de práctica clínica recientes recomiendan el uso de MTX como FAME de primera línea para la AR, basado en su probada efectividad, excelente perfil de seguridad y bajo coste2-4,8,14-16. Sin embargo, se sigue detectando una considerable variabilidad entre los distintos reumatólogos en lo que se refiere al momento inicial de prescripción del MTX, dosis de comienzo, protocolos de intensificación, intervalo entre incrementos de dosis y vía de administración, así como en la combinación con otros fármacos5,9. Esta variabilidad es manifiesta en este análisis, confirmando la diversidad en la práctica clínica real en el abordaje del paciente con AR.
En estudios publicados sobre la terapia de primera línea con fármacos biológicos, una tercera parte de los pacientes tratados únicamente con MTX conseguían la remisión clínica de la AR17,18. Una revisión sistemática reciente15, ha establecido la utilidad clínica de la monoterapia con MTX en la AR (a dosis semanales entre 5 y 25mg, para periodos de observación entre 12 y 52 semanas); el MTX es bastante bien tolerado, con una tasa de discontinuación, por acontecimientos adversos, de solo el 16% a las 52 semanas. El uso de MTX se asocia también a un 70% de reducción de la mortalidad en la AR, principalmente debido a la disminución de las tasas de muerte debida a episodios cardiovasculares.
La dosis de MTX convencional en los ensayos clínicos como terapia combinada es de 15mg. En nuestro estudio, la dosis media final de MTX en monoterapia antes de combinarlo con FAME biológicos está por debajo de 17mg semanales. A partir de los 15mg, a igualdad de dosis, la biodisponibilidad del MTX es siempre mayor cuando se administra por vía parenteral19. A partir de esta dosificación, y sobre todo para las dosis más altas (25-30mg), se recomienda la inyección parenteral por una mayor eficacia terapéutica con la misma tolerabilidad10,20-24. En nuestro análisis se observa una marcada persistencia en la administración de MTX por vía oral, ya que efectivamente la dosis media en la trasferencia de vía oral a subcutánea es casi de 19mg semanales de MTX (tabla 3). En el estudio CAMERA25 los pacientes con AR no respondedores a una dosificación de MTX por vía oral fueron cambiados a la misma dosis subcutánea, observándose después de este cambio de vía de administración una recuperación de la respuesta clínica. Un estudio observacional retrospectivo y multicéntrico realizado en España comprobó cómo la vía parenteral se utilizaba para administrar dosis más altas de MTX (superiores a 15mg semanales) y en los pacientes con actividad moderada o alta de la enfermedad26.
Recientemente, se ha publicado una investigación con el objetivo de evaluar el uso del MTX para el tratamiento de la AR en EE. UU.27,28, comprobándose como tras 5 años de observación solo el 7% de los individuos utilizaron la vía parenteral para la administración de MTX; la dosis media semanal antes del cambio de vía oral a parenteral fue de 17,5 ± 5mg, y antes de la introducción de tratamiento biológico, 21 ± 5mg. En nuestro análisis (tablas 1 y 2) el intervalo hasta la introducción de un agente biológico oscila entre 6 y 22 meses, siendo la dosis de MTX en el momento de la combinación algo inferior.
En pacientes de edad, se puede detectar más problemas de intolerancia al MTX por diferentes causas (deterioro de la función renal, hipoproteinemia)29; ello podría justificar la menor frecuencia de indicación del MTX detectada en nuestra investigación en los mayores de 65 años. La suplementación con ácido fólico/folínico reduce la tasa de acontecimientos adversos y de suspensión del MTX sin comprometer la eficacia del tratamiento30. En nuestra serie, donde más del 90% de los sujetos recibían suplementos de fólico/folínico, la tasa de interrupción del tratamiento con MTX por problemas de seguridad es baja (15,5%).
El objetivo de este estudio ha sido describir algunos aspectos relevantes sobre la utilización real del MTX en nuestro país, detectando posibles áreas de mejora en beneficio de los pacientes. Observamos que el MTX constituye el pilar del tratamiento de la AR aunque una optimización de su tratamiento, especialmente en lo que se refiere a una escalada de su dosificación y a la selección de la vía de administración correcta en función de la dosis administrada, puede llevar a un mejor control de la AR..
Conflicto de interesesJesús Tornero ha recibido fondos para investigación y formación de Gebro Pharma, Novartis, Pfizer y Roche.
José Luis Andreu, María Auxiliadora Martín, Héctor Corominas, José Javier Pérez Venegas y Fernando Sánchez-Alonso declaran no tener conflicto de intereses.
José Andrés Román-Ivorra ha recibido fondos para investigación, asistencia a Congresos, por ponencias nacionales e internacionales y por asesoría de Abbvie, Actelion, BMS, Celgene, Gebro, Janssen, Lilly, MSD, Novartis, Pfizer, Roche y UCB.