Si bien la neumonitis por hipersensibilidad es la complicación pulmonar más frecuentemente descrita durante el tratamiento con metotrexato, existen otras complicaciones de tipo linfoproliferativo e infeccioso que hay que tener en cuenta dentro del diagnóstico diferencial ante una neumopatía en el contexto de dicho tratamiento. La existencia de un riesgo incrementado de desarrollar procesos infecciosos o reactivaciones de microorganismos latentes puede ser similar al observado a lo largo del tratamiento con antagonistas del factor de necrosis tumoral y corticoides. Dentro de ellas, la neumonía por citomegalovirus es una complicación muy severa a tener en cuenta, ya que el diagnóstico acertado y el tratamiento oportuno evitarán un desenlace potencialmente mortal.
Although hypersensitivity pneumonitis is the most common pulmonary complication described during treatment with methotrexate, other complications like lymphoproliferative and infectious disease may be considered in the study of respiratory disease associated to methotrexate. The existence of an increased risk to developing infectious diseases may be similar to that observed during treatment with antagonists of tumor necrosis factor and corticosteroids, where Cytomegalovirus pneumonia is a serious complication; early diagnosis and treatment will prevent a potentially fatal outcome.
Las complicaciones pulmonares que pueden desarrollar los pacientes en tratamiento con metotrexato se clasifican en inflamatorias, infecciosas y linfoproliferativas1,2. De ellas, la neumonitis por hipersensibilidad es la complicación más frecuente, grave e impredecible, con una incidencia del 1-3% y que, actualmente, con el advenimiento de métodos de ayuda diagnóstica más sofisticados, puede llegar hasta un 7% según lo reportado en algunos estudios más recientes, con una mortalidad de hasta casi un 25%3. Las complicaciones linfoproliferativas, principalmente linfomas no Hodgkin, pueden aparecer durante el tratamiento e incluso tras suspender la medicación y son el resultado directo de la inmunosupresión y la proliferación de células tumorales4. Finalmente, dado el efecto inmunomodulador del metotrexato, el riesgo de desarrollar procesos infecciosos está incrementado a lo largo del tratamiento, siendo los organismos más frecuentemente descritos el Pneumocistis jiroveci, citomegalovirus (CMV), varicela zóster, Nocardia y micobacterias, entre otros; de ellos, el Pneumocistis jiroveci representa casi el 40% de las complicaciones infecciosas en algunas series2,5. El cuadro clínico suele ser inespecífico y común a todas ellas, pudiendo cursar con disnea progresiva, tos, fiebre, taquipnea, hipoxemia y crepitantes secos, presentando en la radiografía de tórax un infiltrado intersticial y/o reticular difuso, de predominio en lóbulos inferiores6.
A continuación, presentamos un caso de neumopatía subaguda severa en una paciente con polimialgia reumática en tratamiento crónico con metotrexato, donde el planteamiento de un adecuado diagnóstico diferencial y el consiguiente tratamiento oportuno permitió una evolución clínica favorable.
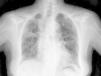
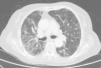
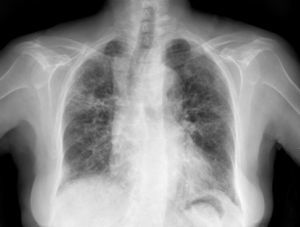
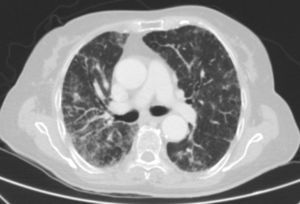
Caso clínicoSe trata de una mujer de 83 años, con antecedentes de hipertensión arterial en tratamiento con amlodipino 5mg/día, enfermedad renal crónica en estadio iii, secundario a nefroangioesclerosis (filtrado glomerular de 45ml/min) y polimialgia reumática en tratamiento crónico con metotrexato 15mg/semanal, desde hace 4 años, aproximadamente. Durante los últimos años ha permanecido con buena estabilidad clínica y analítica, no requiriendo tratamiento corticoideo asociado ni ajustes de su medicación habitual. Seis semanas previas al ingreso presentó de forma progresiva astenia, disnea, tos productiva y pérdida ponderal de 5 kg durante este tiempo. No fiebre termometrada, no artralgias ni debilidad muscular. En el ingreso, se objetivó disnea en reposo con saturación de oxigeno basal del 90%, auscultación pulmonar con crepitantes finos bilaterales, no adenomegalias ni visceromegalias palpables, elevación de la velocidad de sedimentación globular de 69mm, proteína C reactiva de 3,5mg/dl y radiografía de tórax, donde destacó un infiltrado reticular bilateral difuso y asimétrico con afectación periférica, más acentuado en las bases y en el lóbulo superior derecho (fig. 1). Tras realizar un diagnóstico diferencial de neumopatía subaguda en el contexto de la paciente, la sospecha de neumopatía por metotrexato fue el principal planteamiento, por lo que se suspendió dicho tratamiento, se inició corticoterapia por vía intravenosa de 48mg/día de metilprednisolona y medidas de soporte, a pesar de lo cual no se objetivó clara mejoría. Se realizó una tomografía axial computarizada de alta resolución (TACAR) torácico, objetivándose un engrosamiento intersticial parcheado de predominio periférico y en las bases pulmonares, así como pequeñas adenopatías mediastínicas inespecíficas (fig. 2). Las pruebas de función respiratoria mostraron una espirometría forzada con valores en el límite bajo de la normalidad, con una capacidad vital forzada (FVC) de 1.340ml (82%), un volumen de flujo espiratorio en el primer segundo (FEV1) de 1.130ml (88%) y el cociente FEV1/FVC del 84%, asociado a un descenso grave de la difusión pulmonar de monóxido de carbono (DLCO) del 33% y corregido según el volumen alveolar (KCO) del 54%. En el resto de las pruebas complementarias, no se evidenciaron alteraciones en el hemograma, la serología para gérmenes atípicos, el estudio de marcadores tumorales, los hemocultivos, el estudio seriado de esputo ni en el Mantoux/Booster, por lo que se realizó una broncoscopia con estudio del lavado broncoalveolar (LBA) y broncoaspirado, obteniéndose resultado positivo en la reacción en cadena de la polimerasa (PCR) para CMV asociado a un incremento del índice de linfocitos CD4/CD8 de 3.47, con el resto de estudio para gérmenes comunes, tuberculosis, Pneumocistis jiroveci y hongos negativo. Se amplió el estudio microbiológico detectándose IgG para CMV (+), IgM para CMV (–) y carga viral CMV en plasma (+), por lo que se inició tratamiento por vía intravenoso, ajustado según función renal, con ganciclovir 300mg/12 h durante 14 días, cambiando posteriormente a valganciclovir 900mg/12 h por vía oral durante 14 días, con buena tolerancia a la medicación y respuesta clínica, mejorando los parámetros radiológicos, serológicos (carga viral CMV indetectable) y de función respiratoria (DLCO 57,52%, KCO 80,90%, FVC 1.950ml [119%] y FEV1 de 1.680ml [130%]).
Si bien la neumonitis por hipersensibilidad secundaria al tratamiento por metotrexato es la complicación pulmonar de este fármaco más descrita en la literatura2,3,6, algunas series, como la descrita por Sathi et al., mencionan que su frecuencia sería menor si se diagnostica basándose en criterios clínicos, alteraciones radiográficas, resultados del TACAR torácica, hallazgos en el LBA, estudio histopatológico y respuesta terapéutica tras suspender la medicación, por lo que en su valoración y diagnóstico diferencial deben considerarse otras entidades, como procesos infecciosos, fibrosis pulmonar, procesos infiltrativos, etc.7. Con respecto a la asociación entre el desarrollo de procesos infecciosos y el tratamiento con metotrexato, se ha demostrado que existe un riesgo incrementado para el desarrollo de infecciones por gérmenes comunes, más que con cualquier otro fármaco antirreumático modificador de la enfermedad (FAME) no biológico; sin embargo, aún no se ha establecido claramente su papel en el riesgo de infecciones o reactivaciones por gérmenes oportunistas, como el que se observa a lo largo del tratamiento con antagonistas del factor de necrosis tumoral y corticoides (dosis de prednisona > 10mg/día o equivalentes)8,9.
El CMV es un ADN virus perteneciente a la familia de los Herpesvirus, que se transmite por contacto directo con secreciones corporales, contacto sexual, transfusiones o trasplantes; la infección por CMV en la población inmunocompetente generalmente cursa de forma asintomática, permaneciendo después como una infección latente, con una tasa de seropositividad en la población general que oscila entre el 30 y el 70%; sin embargo, ocasionalmente puede originar severas complicaciones, con una significativa morbimortalidad10. La reactivación de esta infección puede ocurrir a lo largo de toda la vida, incrementándose el riesgo cuando se produce algún tipo de inmunosupresión, sea secundaria a otra enfermedad, infecciones o tratamientos11. El desarrollo de una neumonía por CMV es una complicación muy severa que se caracteriza por una insuficiencia respiratoria progresiva y un infiltrado intersticial difuso en la radiografía de tórax, por lo que su diagnóstico y tratamiento precoz con antivirales, como el ganciclovir y/o el valganciclovir, son determinates10,12. El diagnóstico se basará en la elevación de IgM o IgG para CMV, el estudio radiológico compatible, la positividad de la PCR para CMV en el LBA y el estudio histológico, que revelará la presencia de cuerpos de inclusión (el uso de PCR para CMV en sangre de pacientes inmunocompetentes suele ser negativo, aunque si es positivo es diagnóstico)13,14.
ConclusionesPor todo lo mencionado anteriormente, al abordar el manejo de una neumopatía intersticial en un paciente en tratamiento crónico con metotrexato, si bien la neumonitis por hipersensibilidad es la complicación habitualmente más publicada, se deben tener en cuenta otras posibilidades diagnósticas, como las de etiología infecciosa, ya que el tratamiento será totalmente distinto e incluso podría ensombrecer el pronóstico. Asimismo, aunque haya controversias con respecto al desarrollo de infecciones oportunistas, este caso, así como otros descritos en la literatura, refuerzan la idea de ampliar nuestro abanico de posibilidades, con lo cual se logrará un diagnóstico acertado y tratamiento oportuno de una complicación potencialmente mortal.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.