Se describe el caso de un paciente con enfermedad de Behçet y enteropatía perdedora de proteínas secundaria a linfangiectasia intestinal.
We report an unusual case of a patient with Behçet's disease that developed protein-losing enteropathy due to intestinal lymphangiectasia.
La enfermedad de Behçet (EB) es una entidad inflamatoria multisistémica de etiología desconocida con compromiso musculoesquelético, ocular y mucocutáneo recurrente1. Presenta una distribución mundial, sin embargo, es más frecuente en los países que constituían la antigua «ruta de la seda»2. Las lesiones vasculares están presentes en el 40% de pacientes y puede comprometer a vasos de cualquier calibre3. El territorio venoso es el que se afecta con mayor frecuencia (75%). Las manifestaciones más comunes son la tromboflebitis y la trombosis de los miembros inferiores4, seguidas por la trombosis de la vena cava, aneurismas de la arteria pulmonar y síndrome de Budd-Chiari5,6. La expresividad clínica de la trombosis varía en función del grado de oclusión y del lugar anatómico afectado; un trombo en la vena cava inferior puede ser causa de hipertensión portal.
La linfangiectasia intestinal es una rara pero grave causa de enteropatía perdedora de proteínas. Es originada por una obstrucción en la circulación venosa y linfática, que produce aumento en su presión, con dilatación y rotura secundaria de los vasos linfáticos de la pared intestinal7. El duodeno es la porción intestinal más afectada8. Se manifiesta como hipoproteinemia, linfopenia y diminución de los niveles de inmunoglobulinas. Los niveles elevados de alfa 1 antitripsina fecal confirman el diagnóstico7. Es necesario realizar exploraciones complementarias, como, por ejemplo, la endoscopia digestiva alta o cápsula endoscópica, dirigidas al estudio de la enfermedad de base tales como la enfermedad de Menétrier, la gastroenteritis eosinofílica y la enfermedad de Whipple9.
A continuación, presentamos el caso clínico de un hombre joven afectado de EB, complicado con hipertensión portal por múltiples trombosis que cursó con enteropatía pierde proteína secundaria a linfangiectasia intestinal.
Observación clínicaHombre de 38 años, natural de Marruecos, residente en España desde hace 11 años. Diagnosticado de EB a los 28 años a raíz de un estudio de trombosis de vena cava superior y episodios recurrentes de foliculitis, fenómeno de patergia, úlceras orales y genitales. Durante la evolución de la enfermedad, presentó trombosis en la vena cava inferior, tronco braquiocefálico derecho e izquierdo y venas suprahepáticas. Recibía como tratamiento 5mg de prednisona cada 24 h, 50mg de azatioprina cada 8 h, 0,5mg de colchicina cada 24 h y aldocumar en pauta móvil, aunque con mal cumplimiento terapéutico por sociopatía asociada.
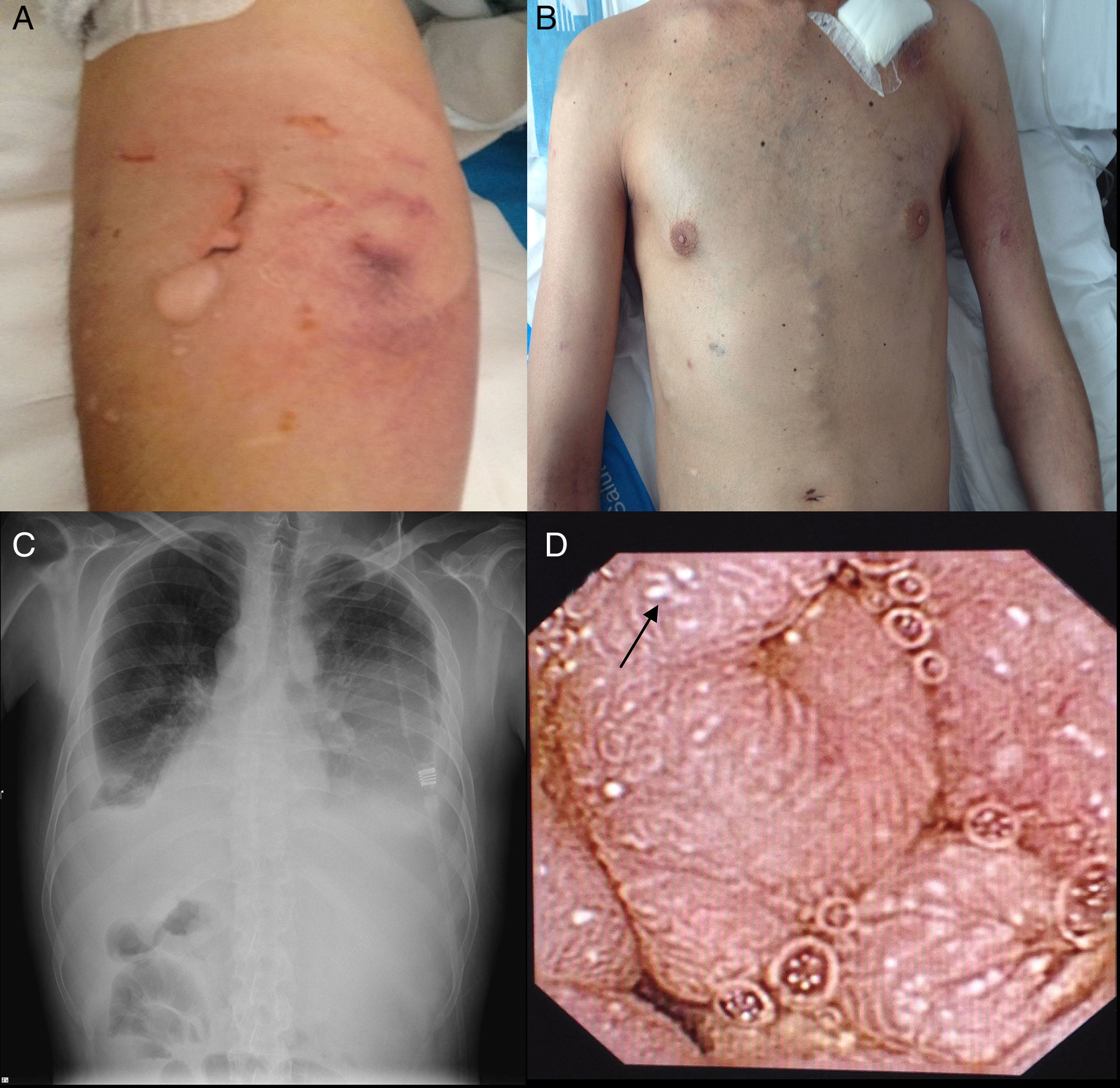
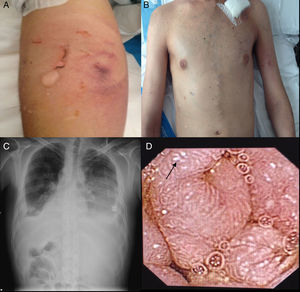
Consultó al Servicio de Urgencias por disnea, febrícula y malestar general. En el examen físico se evidenciaron palidez marcada, taquipnea, 90% de saturación basal de oxígeno, múltiples úlceras orales, foliculitis en brazos y la zona suprapúbica, fenómeno de patergia (fig. 1A) edemas de miembros inferiores, circulación colateral en «cabeza de medusa» en el tórax y en el abdomen (fig. 1B), hepatomegalia de 4 traveses de dedo e hipofonesis bibasal en la auscultación pulmonar. En la radiografía de tórax, se evidenció derrame pleural bilateral (fig. 1C), por lo que se realizó una toracocentesis que mostró un trasudado no infectado sin presencia de gérmenes a la tinción de Gram y con cultivo bacteriológico negativo. En la analítica desatacaban leucocitosis y elevación de reactantes de fase aguda (tabla 1). Ante la sospecha de una infección respiratoria, se inició tratamiento antibiótico empírico con meropenem.
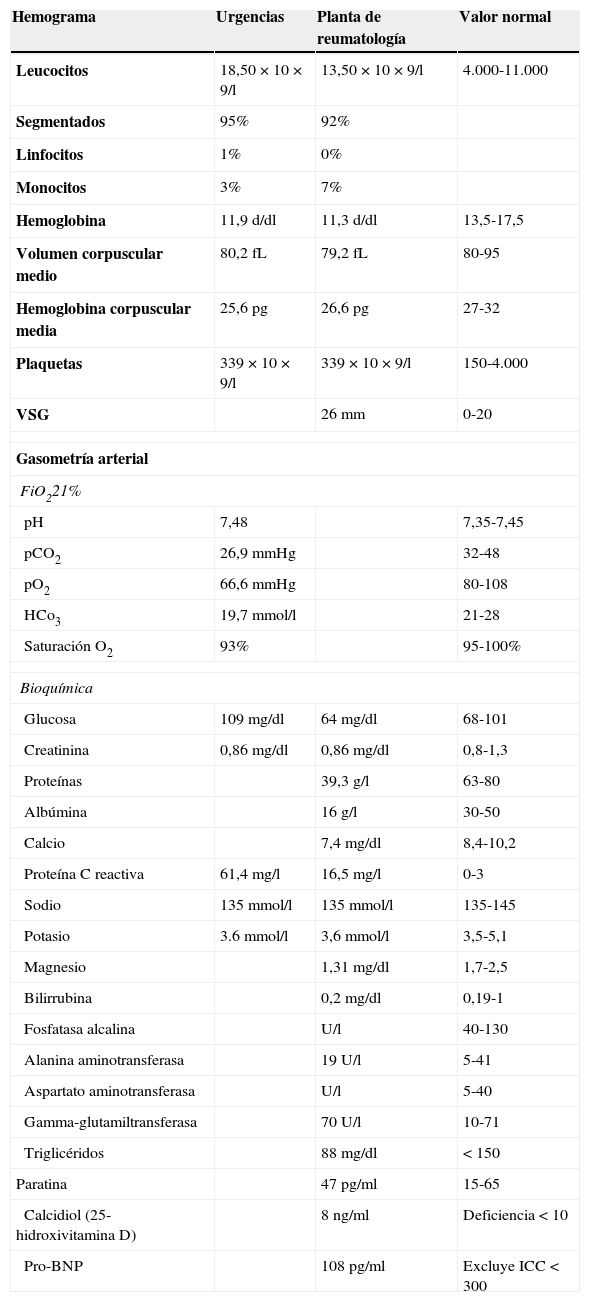
Analítica en urgencias y planta de reumatología
| Hemograma | Urgencias | Planta de reumatología | Valor normal |
|---|---|---|---|
| Leucocitos | 18,50×10×9/l | 13,50×10×9/l | 4.000-11.000 |
| Segmentados | 95% | 92% | |
| Linfocitos | 1% | 0% | |
| Monocitos | 3% | 7% | |
| Hemoglobina | 11,9 d/dl | 11,3 d/dl | 13,5-17,5 |
| Volumen corpuscular medio | 80,2 fL | 79,2 fL | 80-95 |
| Hemoglobina corpuscular media | 25,6pg | 26,6pg | 27-32 |
| Plaquetas | 339×10×9/l | 339×10×9/l | 150-4.000 |
| VSG | 26mm | 0-20 | |
| Gasometría arterial | |||
| FiO221% | |||
| pH | 7,48 | 7,35-7,45 | |
| pCO2 | 26,9mmHg | 32-48 | |
| pO2 | 66,6mmHg | 80-108 | |
| HCo3 | 19,7mmol/l | 21-28 | |
| Saturación O2 | 93% | 95-100% | |
| Bioquímica | |||
| Glucosa | 109mg/dl | 64mg/dl | 68-101 |
| Creatinina | 0,86mg/dl | 0,86mg/dl | 0,8-1,3 |
| Proteínas | 39,3g/l | 63-80 | |
| Albúmina | 16g/l | 30-50 | |
| Calcio | 7,4mg/dl | 8,4-10,2 | |
| Proteína C reactiva | 61,4mg/l | 16,5mg/l | 0-3 |
| Sodio | 135mmol/l | 135mmol/l | 135-145 |
| Potasio | 3.6mmol/l | 3,6mmol/l | 3,5-5,1 |
| Magnesio | 1,31mg/dl | 1,7-2,5 | |
| Bilirrubina | 0,2mg/dl | 0,19-1 | |
| Fosfatasa alcalina | U/l | 40-130 | |
| Alanina aminotransferasa | 19 U/l | 5-41 | |
| Aspartato aminotransferasa | U/l | 5-40 | |
| Gamma-glutamiltransferasa | 70 U/l | 10-71 | |
| Triglicéridos | 88mg/dl | < 150 | |
| Paratina | 47pg/ml | 15-65 | |
| Calcidiol (25-hidroxivitamina D) | 8ng/ml | Deficiencia<10 | |
| Pro-BNP | 108pg/ml | Excluye ICC<300 | |
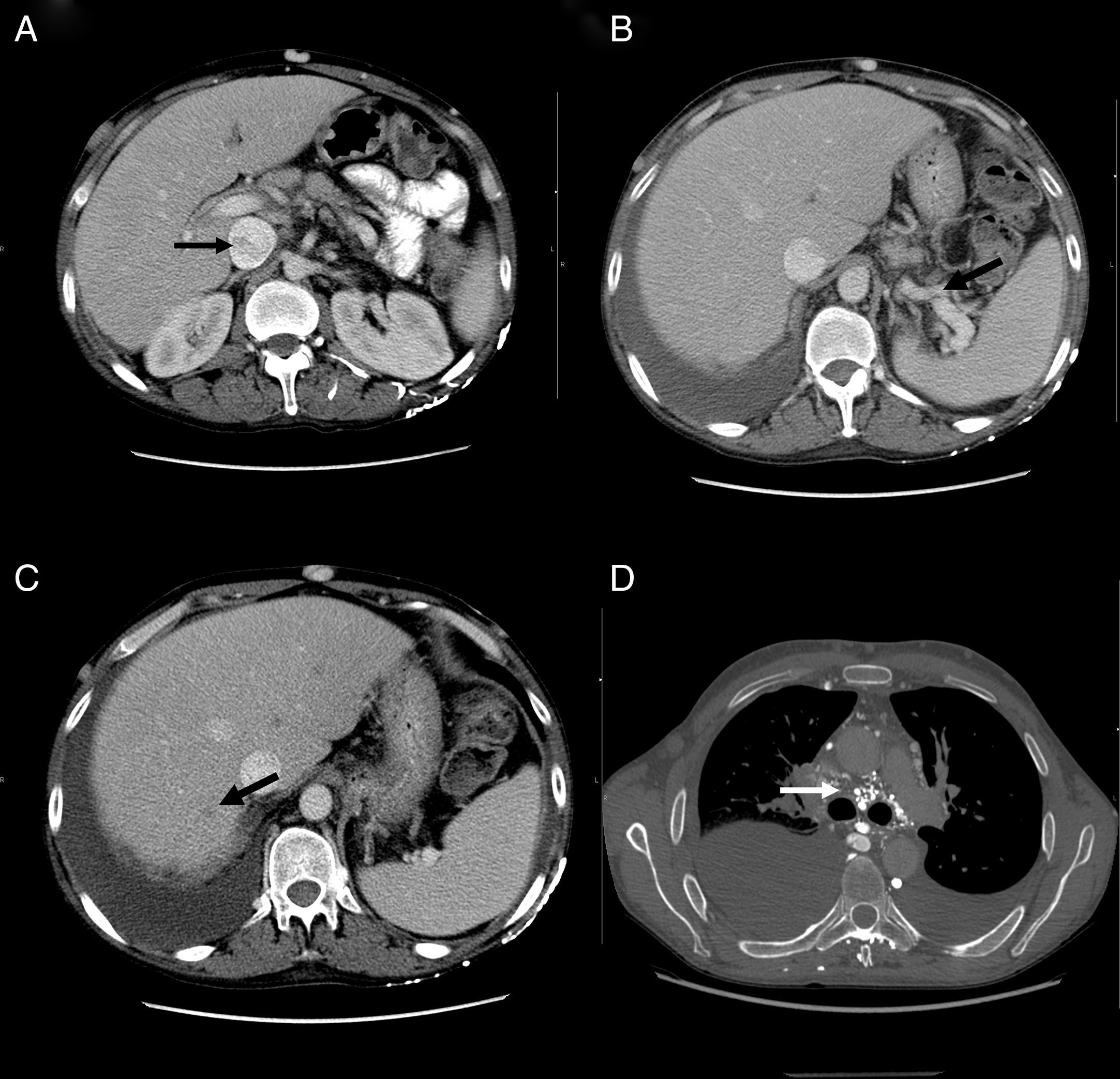
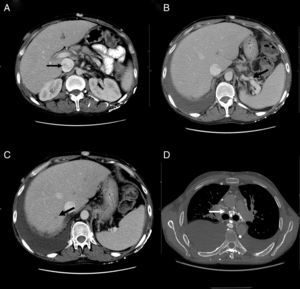
Durante su ingreso, se constató aumento de los edemas de miembros inferiores, al que se le añade edema escrotal y de pared abdominal. Se inició tratamiento diurético con parcial mejoría. En la analítica de ingreso (tabla 1) destacaba la persistencia de leucocitosis, elevación de reactantes de fase aguda, hipoproteinemia e hipoalbuminemia, función hepática y renal normal. El estudio de autoinmunidad (anticuerpos antinucleares, anticuerpos extraíbles del núcleo, anticuerpos anticitoplasmáticos, factor reumatoide, anticuerpos anti citrulinas), los hemocultivos, la serología viral para hepatitis B y C y virus de inmunodeficiencia humana fueron negativos. Se practicó un ecocardiograma que mostró un mínimo derrame pericárdico, sin signos sugestivos de constricción. Una ecografía Doppler de abdomen constató la presencia de hepatomegalia homogénea y ascitis leve. Las venas suprahepáticas media e izquierda sin presencia de flujo (síndrome de Budd-Chiari). La vena suprahepática derecha estaba parcialmente permeable con flujo monofásico y la vena cava inferior presentaba un ligero aumento de calibre. Se evidenciaron además signos de hipertensión portal con circulación colateral en el hilio esplénico, retroperitoneal y repermeabilización de la vena umbilical. Estos hallazgos se corroboraron en una tomografía abdominal (fig. 2A-C). En el estudio de orina, se observó una proteinuria de 0,1g/24 h. Dada la presencia de hipoproteinemia, hipoalbuminemia y déficit vitamínico, se sospechó de un síndrome malabsortivo. El estudio de transglutaminasa sérica también resultó normal. Se practicó una biopsia de grasa abdominal subcutánea, en donde no se evidenció material amiloide. La colonoscopia y la ileoscopia descartaron la presencia de ileítis. Debido a la hipertensión venosa portal, esplácnica y enteropatía pierdeproteína, se sospechó de linfangiectasia intestinal que se confirmó con la elevada excreción elevada de alfa 1 antitripsina fecal (2,85mg/g-valor normal < 0,3) e imágenes compatibles halladas con cápsula endoscópica en el tracto duodenal (fig. 1D). Durante su estancia, el paciente cursó con episodios recurrentes de tromboflebitis, por lo que precisó de la colocación de una vía central (femoral) que se trombosó a las 72 h. Ante la imposibilidad de administración de tratamiento por vía intravenosa, se colocó una vía central con ayuda de arteriografía con evidencia de gran circulación colateral en el tórax y supraclavicular (fig. 2D). La yugular interna se encontraba disminuida de calibre y la yugular externa dilatada, a la inyección de contraste se apreciaba una trombosis de ambos troncos innominados con abundante circulación colateral que drenaban a la vena pericardiofrénica. Se logró cateterizar dicha vena, donde se colocó un reservorio subcutáneo bicameral que el paciente toleró únicamente 24 h por dolor en el momento de la administración de la medicación.
A) Tomografía computarizada, corte axial: muestra heterogenicidad de la vena cava inferior. B) Tomografía computarizada, corte axial: muestra circulación colateral en el hilo esplénico. C) Tomografía computarizada, corte axial: muestra defecto de repleción suprahepática. D) Angiotomografía, corte axial: muestra circulación colateral mediastínica.
El tratamiento por vía oral también se vio limitado por la escasa absorción intestinal. El paciente recibió tratamiento con seroalbúmina, furosemida por vía intravenosa, suplementos vitamínicos y octeotrida (por vía periférica) con buenos resultados. Para el control de la EB se prescribió metotrexato 15mg semanal y enoxaparina sódica por vía subcutánea asociado a 10mg de prednisona cada 24 h; para asegurar su absorción, se decidió el uso de vía sublingual.
El paciente presentó además episodios de candidiasis y herpes oral que se trataron con antifúngicos y antivirales por vía intravenosa.
Al alta hospitalaria, los edemas remitieron y el derrame pleural se redujo notablemente. Las cifras de leucocitos y de reactantes de fase aguda se normalizaron. Su estado nutricional mejoró considerablemente.
Actualmente, tras un año del diagnóstico de linfangiectasia intestinal, el paciente es controlado en consultas externas de Reumatología y Digestivo.
DiscusiónLa EB, caracterizada por la presencia de úlceras bucogenitales recurrentes, uveítis, artritis y lesiones cutáneas, es la única entre las vasculitis que puede afectar a vasos de cualquier calibre1. Esta enfermedad afecta principalmente a las venas y cursa con episodios trombóticos, en muchos casos de difícil manejo debido a su carácter recurrente y a los síndromes secundarios relacionados al trombo6. La linfangiectasia intestinal es una causa de enteropatía pierdeproteína cuya base fisiopatológica es la dilatación de los vasos linfáticos intestinales. Puede ser primaria o secundaria a un trastorno obstructivo9. En el presente caso se cree que la linfangiectasia intestinal asociada a la EB es secundaria a la hipertensión portal causada por los múltiples trombos en el territorio portal. Morita et al.10 evidenciaron un aumento en el número de vasos linfáticos iliopélvicos y lumbares en linfogramas de pacientes afectados de EB y linfangiectasia intestinal; concluyeron que la dilatación de las vías linfáticas podría estar relacionada a un aumento en el flujo causado por la hiperpermeabilidad vascular y no un bloqueo en la circulación de la linfa.
Tal y como se ilustra en el presente caso, debido a la baja presión oncótica originada por la hipoproteinemia, los pacientes cursan con ascitis, derrame pleural, derrame pericárdico y edemas. Esto contrasta con lo descrito por Asakura et al.11 en 1978, en donde 4 de los 15 pacientes con linfangiectasia intestinal no presentaban hipoproteinemia sérica. Debido a la coexistencia de hipogammaglobulinemia y linfopenia6, las infecciones son frecuentes y pueden aumentar la mortalidad12. Sin embargo, Tsuchiya et al.13 objetivaron que, en comparación con los pacientes con enteropatía perdedora de proteínas, los pacientes con EB y linfangiectasia intestinal no presentaban hipogammaglobulinemia.
El diagnóstico de linfangiectasia intestinal se realiza por exclusión, generalmente en pacientes con estudio de enteropatía perdedora de proteínas, en el que se detecta elevación de alfa 1 antitripsina fecal7 e imágenes indicativas halladas por gastroscopia o cápsula endoscópica14.
En nuestro caso, al igual que en la literatura, no se pudo realizar la confirmación histopatológica, ya que esta se realiza en un mínimo porcentaje de casos. Por ejemplo, en una serie de 1.866 pacientes con sospecha de linfangiectasia intestinal, la confirmación histopatológica se realizó únicamente en el 1,9%15. El tratamiento se basa en la reposición de proteínas de alto peso molecular, restricción de grasas, suplementos vitamínicos16,17 y manejo de la enfermedad de base. La restricción de grasas de cadena corta previene la rotura de los vasos linfáticos11. Se ha descrito en la literatura la eficacia de octeotrida, a pesar de que su mecanismo de acción no está esclarecido18. La infusión de seroalbúmina humana es un tratamiento de soporte que permite mantener la presión oncótica y mejorar los edemas mientras se instaura el tratamiento de fondo9. El tratamiento de las trombosis en la EB varía según las revisiones, sin existir ninguno de elección. El papel de la anticoagulación en la trombosis venosa profunda no está bien establecida y existen publicaciones discrepantes19-21. Estudios retrospectivos muestran que el tratamiento anticoagulante es inefectivo para la prevención de las trombosis; sin embargo, al añadir inmunosupresores el riesgo de retrombosis disminuye significativamente. La experiencia con tratamiento fibrinolítico o las endoprótesis es escasa22.
ConclusiónEste caso ilustra las complicaciones de las trombosis en un paciente con EB, que desarrolla un cuadro de linfangiectasia intestinal secundaria. Se debe sospechar de linfangiectasia intestinal en pacientes con EB, hipertensión portal y enteropatía perdedora de proteínas.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.