El síndrome de Sjögren (SS) es una enfermedad sistémica autoinmune que afecta principalmente a las glándulas exocrinas. Se ha reportado que la asociación entre SS y compromiso respiratorio ocurre entre el 11 y el 45% de los casos. El diagnóstico se basa en la integración de criterios clínicos, inmunológicos e histopatológicos. Se presenta el caso de un masculino de 58 años, con SS, disnea grave y exacerbaciones recurrentes de la vía respiratoria, asociado a bronquiolitis-bronquiectasias. La ausencia de anticuerpos anti-Ro y anti-La, relacionados con la gravedad de la bronquiolitis, es una forma de presentación poco caracterizada en este grupo de pacientes, más aún, su tratamiento óptimo no está establecido.
Sjögren's syndrome (SS) is a systemic autoimmune disease that mainly affects the exocrine glands. It has been reported that the association between SS and respiratory involvement occurs in 11% and 45% of cases, and can be the initial manifestation of the disease. The diagnosis is based on the integration of clinical, immunological and histopathological criteria. This paper examines a 58-year-old man with SS, severe dyspnea and recurrent exacerbations associated with bronchiolitis-bronchiectasis. The absence of anti-Ro and anti-La antibodies associated with severe bronchiolitis is a clinical presentation that is poorly characterized in this group of patients; moreover, how to treat them remains unclear.
El síndrome de Sjögren (SS) es una enfermedad autoinmune que afecta principalmente las glándulas exocrinas; sin embargo, puede involucrar órganos extraglandulares1-3. Los anticuerpos anti-Ro son negativos en 5-10% de los casos y la biopsia de glándula salival evidencia 69% de los casos.3 Se ha reportado que la interacción entre SS y afección respiratoria ocurre hasta en un 45%; las complicaciones más frecuentes incluyen: bronquiectasias y neumopatía intersticial4-6. Sin embargo, existen pocos reportes que describan el perfil clínico de SS y bronquiolitis.7 Se presenta a un hombre con disnea progresiva con SS primario seronegativo asociado a bronquiolitis.
Observación clínicaMasculino de 58 años de edad. COMBE negativo. Niega tabaquismo ni exposiciones laborales o ambientales a sustancias orgánicas o inorgánicas, hongos o enfermedad por reflujo gastroesofágico. Manifestaba síntomas de 5 meses de evolución caracterizados por escozor ocular, tos en accesos y expectoración mucohialina escasa. Enfatizaba episodios recurrentes definidos como infecciones respiratorias. En el examen físico se encontró hiperemia conjuntival; ambos hemitórax con crepitantes finos y roncus en regiones subaxilares e infraescapulares. El resto del examen, sin anormalidades.
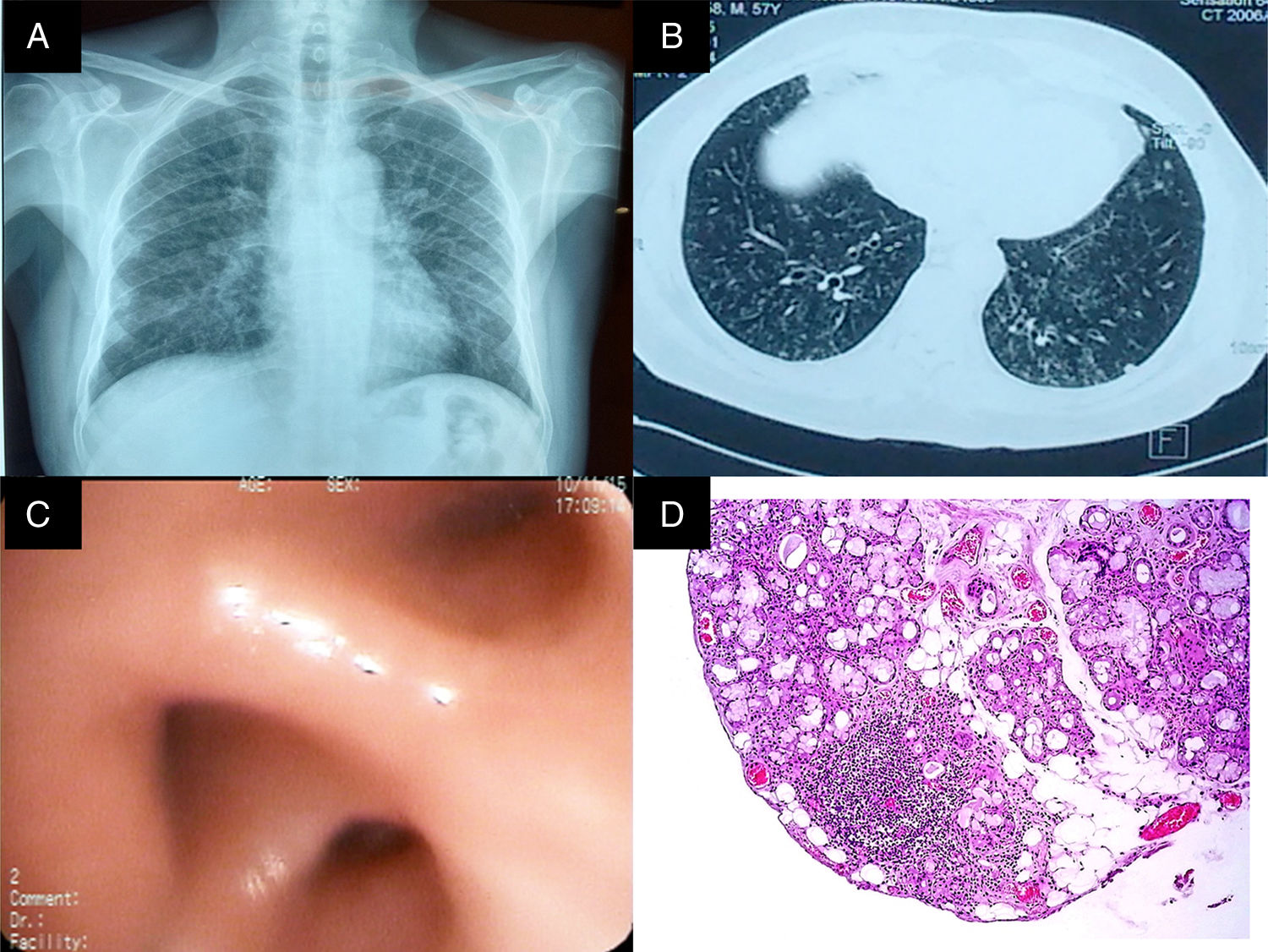
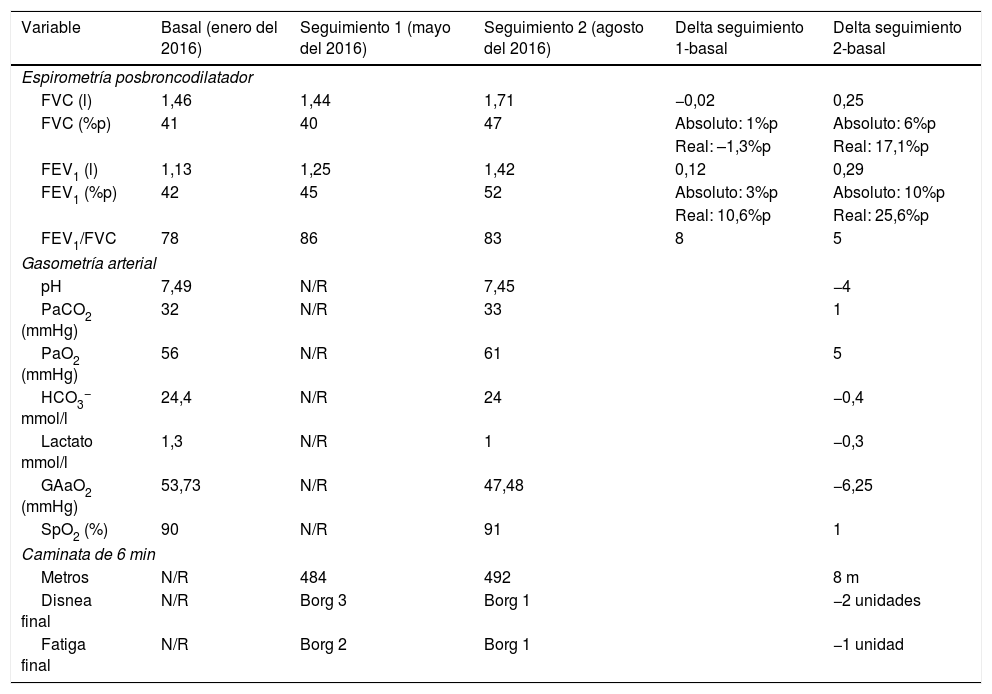
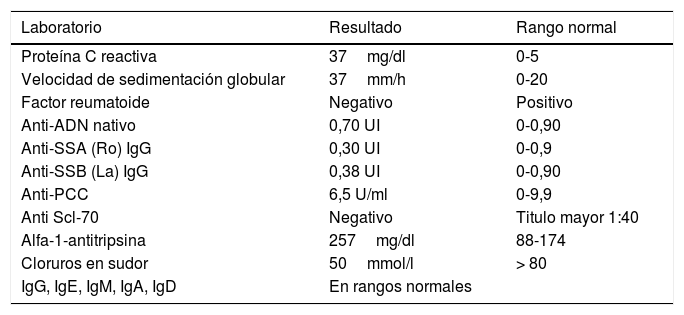
La radiografía de tórax (fig. 1 panel A), con opacidades que involucraban el intersticio pulmonar. Por tal motivo, se realizó una tomografía axial de alta resolución de tórax que mostró bronquiectasias, nódulos centrilobulillares y zonas con árbol en gemación (fig. 1 panel B). El análisis de la función pulmonar documentó restricción grave sin reversibilidad (tabla 1). Sobre la base de los elementos recabados, se intervino por vía broncoscopia observando edema de la mucosa bronquial (fig. 1 panel C); el análisis por patología de la biopsia únicamente demostró infiltración neutrofílica. Por otro lado, el cultivo de biopsia y el lavado broncoalveolar (LBA) para bacterias y bacilos ácido-alcohol resistentes, y el cultivo de Sabouraud se reportaron negativos. Adicionalmente, la proteína C reactiva en biopsia y el LBA para Mycobacterium tuberculosis fueron negativos. El panel reumatológico y otros paraclínicos pertinentes fueron negativos (tabla 2).
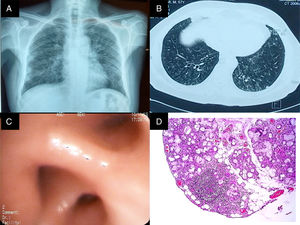
A) Rx de tórax PA. Imágenes compatibles con patrón reticulonodular bilateral, predominantemente basal, con tamaño pulmonar conservado. B) TACAR de tórax con imágenes en anillo de sello en ambos pulmones, nódulos centrilobulillares y patrón en árbol en gemación. C) Bronquio del lóbulo inferior derecho con edema y disminución concéntrica de los orificios de la pirámide basal. D) Biopsia de glándula salival. Infiltrado inflamatorio de predominio linfocítico, con formación de 2 agregados linfoides de más de 50 células/mm2.
Análisis de la función pulmonar en el seguimiento del caso
| Variable | Basal (enero del 2016) | Seguimiento 1 (mayo del 2016) | Seguimiento 2 (agosto del 2016) | Delta seguimiento 1-basal | Delta seguimiento 2-basal |
|---|---|---|---|---|---|
| Espirometría posbroncodilatador | |||||
| FVC (l) | 1,46 | 1,44 | 1,71 | −0,02 | 0,25 |
| FVC (%p) | 41 | 40 | 47 | Absoluto: 1%p | Absoluto: 6%p |
| Real: –1,3%p | Real: 17,1%p | ||||
| FEV1 (l) | 1,13 | 1,25 | 1,42 | 0,12 | 0,29 |
| FEV1 (%p) | 42 | 45 | 52 | Absoluto: 3%p | Absoluto: 10%p |
| Real: 10,6%p | Real: 25,6%p | ||||
| FEV1/FVC | 78 | 86 | 83 | 8 | 5 |
| Gasometría arterial | |||||
| pH | 7,49 | N/R | 7,45 | −4 | |
| PaCO2 (mmHg) | 32 | N/R | 33 | 1 | |
| PaO2 (mmHg) | 56 | N/R | 61 | 5 | |
| HCO3− mmol/l | 24,4 | N/R | 24 | −0,4 | |
| Lactato mmol/l | 1,3 | N/R | 1 | −0,3 | |
| GAaO2 (mmHg) | 53,73 | N/R | 47,48 | −6,25 | |
| SpO2 (%) | 90 | N/R | 91 | 1 | |
| Caminata de 6 min | |||||
| Metros | N/R | 484 | 492 | 8 m | |
| Disnea final | N/R | Borg 3 | Borg 1 | −2 unidades | |
| Fatiga final | N/R | Borg 2 | Borg 1 | −1 unidad | |
Delta absoluto: diferencia registrada con base en el cambio de las unidades porcentuales tomando como referencia el basal; Delta real: diferencia registrada con base en el cambio de volumen pulmonar tomando como referencia el basal; FEV1: volumen espiratorio forzado en el primer segundo; FEV1/FVC: relación FEV1/FVC: cociente de FEV1/FVC; FVC: capacidad vital forzada; GAaO2: gradiente alvéolo-arterial de oxígeno; HCO3: bicarbonato; PaCO2: presión arterial de dióxido de carbono; PaO2: presión arterial de oxígeno; SpO2: saturación de oxígeno por pulsioximetría; %p: porcentaje del predicho.
Informe de estudios inmunológicos en suero
| Laboratorio | Resultado | Rango normal |
|---|---|---|
| Proteína C reactiva | 37mg/dl | 0-5 |
| Velocidad de sedimentación globular | 37mm/h | 0-20 |
| Factor reumatoide | Negativo | Positivo |
| Anti-ADN nativo | 0,70 UI | 0-0,90 |
| Anti-SSA (Ro) IgG | 0,30 UI | 0-0,9 |
| Anti-SSB (La) IgG | 0,38 UI | 0-0,90 |
| Anti-PCC | 6,5 U/ml | 0-9,9 |
| Anti Scl-70 | Negativo | Titulo mayor 1:40 |
| Alfa-1-antitripsina | 257mg/dl | 88-174 |
| Cloruros en sudor | 50mmol/l | > 80 |
| IgG, IgE, IgM, IgA, IgD | En rangos normales |
Ig: inmunoglobulina; PCC: péptido citrulinado cíclico; UI: unidades internacionales.
Debido al antecedente de hiperemia conjuntival, se realizó una prueba de Schirmer, con resultados positivos. Sobre la base de este hallazgo, y ante la negatividad de los anticuerpos, se llevó a cabo una biopsia de glándula salival que evidenció sialoadenitis crónica grado 4.1 de la clasificación de Chisholm y Mason (fig. 1 panel D). Actualmente, el paciente recibe tratamiento con esteroides, metotrexato, broncodilatadores, macrólidos y corticoides inhalados, con lo cual tiene menor sintomatología y mejoría de la función pulmonar (tabla 1).
DiscusiónEl presente caso es relevante por: 1) la presentación seronegativa del SS con manifestaciones respiratorias infrecuentes, y 2) la asociación de bronquiolitis con manifestaciones de función pulmonar grave en el SS.
Sobre la base del índice de actividad de la Liga Europea contra las Enfermedades Reumatológicas (ESSDAI, por sus siglas en inglés), el pulmón ocupa el 2.° lugar en frecuencia entre los órganos afectados por estas entidades clínicas6. Se consideraba que la enfermedad pulmonar intersticial era la principal manifestación del aparato respiratorio; sin embargo, se ha encontrado una frecuencia cada vez mayor de bronquiectasias-bronquiolitis8. Cabe destacar que los anticuerpos anti-Ro/SSA son positivos en 27-50% de los pacientes con SS y bronquiectasias; de estos, solo el 41% cumple los criterios diagnósticos del consenso americano-europeo9. Más aún, el escenario se encarece al utilizar los criterios de la Alianza Internacional de Sjögren, dado que únicamente 27% de los pacientes cumplen los criterios diagnósticos3. Así entonces, podemos reflexionar que los marcadores serológicos no deben ser considerados, per se, indicadores diagnósticos debido a que existen enfermos con anticuerpos negativos. La expresión clínica de la enfermedad obligó a descartar, mediante una ruta de mayor a menor frecuencia, las causas que pudieran relacionarse con los hallazgos respiratorios de nuestro caso. Sobre la base de este argumento, al excluir sistemáticamente las causas más comunes de bronquiolitis (v. gr., tuberculosis, micosis, exposiciones a sustancias inorgánicas, etc.), nos enfocamos en la manifestación ocular de sicca como dato clave para tomar una biopsia de glándula salival. Por otra parte, cabe mencionar que los nódulos centrilobulillares y el patrón de árbol en gemación documentado en el presente caso suelen ser relacionados con bronquiolitis folicular o linfocítica y se han informado estas alteraciones tomográficas en el 6-24% de los casos con Sjögren y afección pulmonar2,4.
Sobre la base de nuestro conocimiento, la evolución del SS que compromete la vía aérea pequeña no ha sido descrita en población latina y el comportamiento informado en otra población rara vez tiene matices graves7. Del mismo modo, es infrecuente considerar el diagnóstico de SS como un diferencial en escenarios de bronquiolitis crónica4,7,9.
Existen reportes donde se destaca que las pruebas de función pulmonar en pacientes con SS y compromiso respiratorio habitualmente revelan patrones de restricción u obstrucción leves4,9,10. No obstante, Borie et al. han informado casos similares al nuestro, donde existe mayor compromiso en la función pulmonar caracterizado por restricción muy grave7. Una limitante para el entendimiento de esta forma de presentación es que, ante la falta de una caracterización clara, la eficacia de diversos tratamientos es desconocida.4
ConclusionesLa evidencia de compromiso en la vía aérea pequeña con alteraciones funcionales graves y recurrencia de exacerbaciones bronquiales obliga a descartar escenarios alternos incluyendo enfermedades autoinmunes como SS. La asociación entre los síntomas clínicos e histológicos es clave en el diagnóstico a pesar de serología negativa.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
AgradecimientoLos autores agradecen al Ing. en Electrónica Baltazar Cortés-Tellez por su apoyo en la edición de imágenes.